Inventio
Vol. 20, núm. 52, 2024
doi: http://doi.org/inventio/10.30973/2024.20.52/7
Flavonoides, un nuevo tratamiento contra la amibiasis
Flavonoids, a new treatment for amebiasis
Munich Guevara Rubio
orcid: 0000-0001-8756-4578, mguevarar@ipn.mx
Escuela Superior de Medicina (esm)/Escuela Nacional de Ciencias Biológicas (encb), Instituto Politécnico Nacional (ipn)
Ivonne Maciel Arciniega Martínez
orcid: 0000-0001-5250-7952, iarciniega@ipn.mx
Escuela Superior de Medicina (esm), Instituto Politécnico Nacional (ipn)
Aldo Arturo Reséndiz Albor
orcid: 0000-0003-1415-5524, aresendiza@ipn.mx
Escuela Superior de Medicina (esm), Instituto Politécnico Nacional (ipn)
Nadia Mabel Pérez Vielma
orcid: 0000-0001-9691-9035, nperezv@ipn.mx
Centro Interdisciplinario de Ciencias de la Salud (cics), Instituto Politécnico Nacional (ipn)
Germán Higuera Martínez
orcid: 0000-0002-2726-1361, cd.higuera.martinez@outlook.com
Escuela Superior de Medicina (esm), Instituto Politécnico Nacional (ipn)
David Levaro Loquio
davidlevaro1@gmail.com
Escuela Superior de Medicina (esm), Instituto Politécnico Nacional (ipn)
Maritza Velásquez Torres
orcid: 0000-0003-0520-6094, maritzatatiana@hotmail.com
Escuela Superior de Medicina (esm), Instituto Politécnico Nacional (ipn)
Judith Pacheco Yépez
orcid: 0000-0003-0283-1812, jpachecoy@ipn.mx
Escuela Superior de Medicina (esm), Instituto Politécnico Nacional (ipn)
resumen
Entamoeba histolytica es el parásito causante de la amibiasis. Este organismo invade el intestino grueso y genera lesiones al nivel del colon y puede propagarse de manera sistémica a otros órganos. Los reportes de la oms indican que afecta principalmente a personas de países en vías de desarrollo, como México, donde se estima una prevalencia del 40% en la población. El uso de plantas medicinales es una de las opciones más buscadas por muchos investigadores. Los flavonoides son fitonutrientes que se encuentran en las plantas. Se sabe que estos compuestos tienen acción como antiparasitarios, antioxidantes, antinflamatorios, antiespasmódicos, antiulcerosos y reguladores del sistema inmunológico.
palabras clave
amibiasis, flavonoides, nuevos compuestos, entamoeba histolytica
abstract
Entamoeba histolytica is the parasite that causes amebiasis. This organism invades the large intestine and causes lesions at the level of the colon and can spread systemically to other organs. who reports that it mainly affects people in developing countries, such as Mexico, where it is estimated to affect 40% of the population. The use of medicinal plants is one of the most sought-after options for many researchers. Flavonoids are phytonutrients found in plants. These compounds are known to have antiparasitic, antioxidant, anti-inflammatory, antispasmodic, anti-ulcer and immunoregulatory effects.
key words
amoebiasis, flavonoids, new compounds, entamoeba histolytica
Recepción: 09/04/24. Aceptación: 11/07/24. Publicación: 2/12/24.
Introducción
Entamoeba histolytica (E. histolytica) es el parásito protozoo causante de la amibiasis en humanos. Este organismo tiene la capacidad de invadir el intestino grueso y generar lesiones necrosantes al nivel del colon, principalmente, y en ocasiones puede propagarse de manera hematógena al corazón, pulmones e hígado, lo que da lugar a infecciones extraintestinales. En condiciones clínicas graves, los pacientes pueden llegar a la muerte (Bruckner, 1992; Olivos-García et al., 2009; Pacheco-Yépez et al., 2011).
Los reportes de la Organización Mundial de la Salud (oms) indican que esta enfermedad afecta sobre todo a personas de países en vías de desarrollo, como México, donde se estima una prevalencia del 40% en la población (Guillén, 2023). La transmisión de E. histolytica puede ocurrir por varios mecanismos. Uno de ellos es la vía oral, a través de la ingestión de alimentos contaminados por su inadecuada manipulación; otro es mediante el consumo de agua contaminada, debido a un déficit en el proceso de potabilización (Atias et. al., 2011).
Diversos trabajos han estimado que el 10% de la población mundial se encuentra infectada con E. histolytica y sólo el 1% de estos pacientes presenta manifestaciones de la infección, cuyas características clínicas comunes son la presencia de sangre y moco en las heces. La infección está basada en el ciclo de vida de E. histolytica, que es simple y consta de dos etapas: el quiste, que es la fase infectiva de resistencia ambiental, y el trofozoíto, que es la fase invasiva que se reproduce en el intestino humano (Guillén, 2023) (figura 1).
Proceso de colonización de E. histolytica
La infección de E. histolytica empieza con la adherencia y el reconocimiento de moléculas de la superficie intestinal. Los parásitos que colonizan son capaces de destruir el tejido a través de citólisis y evaden la respuesta inmune. Este complejo sistema está compuesto por enzimas, como las proteasas de cisteína, proteínas formadoras de poros (ameboporos), entre otras.
La primera línea de defensa inmunológica del hospedero se activa cuando la amiba reconoce los carbohidratos de la célula blanco mediante la lectina de unión a Galactosa/nacetil d-galactosamina (Gal/Galnac), que activa la producción de citocinas, como interleucina 1β (il-1β), interleucina 6 (il-6), interleucina 8 (il-8), interleucina 12 (il-12), interferon gamma (ifn-γ) y factor de necrosis tumoral alfa (tnf-α). Los neutrófilos son activados por el ifn-γ, y producen especies reactivas de oxígeno (ros) y óxido nítrico (no), a través del complejo nicotinamida adenina dinocleótido fosfato oxidasa (nadph oxidasa) y de la sintasa del óxido nítrico inducible (inos). Las moléculas enzimáticas secretadas por el parásito participan en la eliminación de células de la respuesta inmunológica y en la alteración del epitelio intestinal y de los hepatocitos (Nakada-Tsukui y Nozaki, 2016).
Diversos estudios sugieren que las proteasas de cisteína secretadas por la amiba tienen la capacidad de unirse a las glucoproteínas de superficie de las células, provocar una respuesta proinflamatoria y así modular la respuesta inmunológica mediada por las células, a través de la activación de citoquinas proinflamatorias. Al mismo tiempo, la supervivencia del parásito tras la entrada a la circulación mediante sus proteasas lo capacita para sobrevivir en los vasos sanguíneos, a través de la degradación de anticuerpos del sistema inmune y de proteínas del sistema del complemento (complejo proteico y enzimático de la respuesta inmune innata) (Nakada-Tsukui y Nozaki, 2016).
Figura 1
Trofozoítos de Entamoeba histolytica
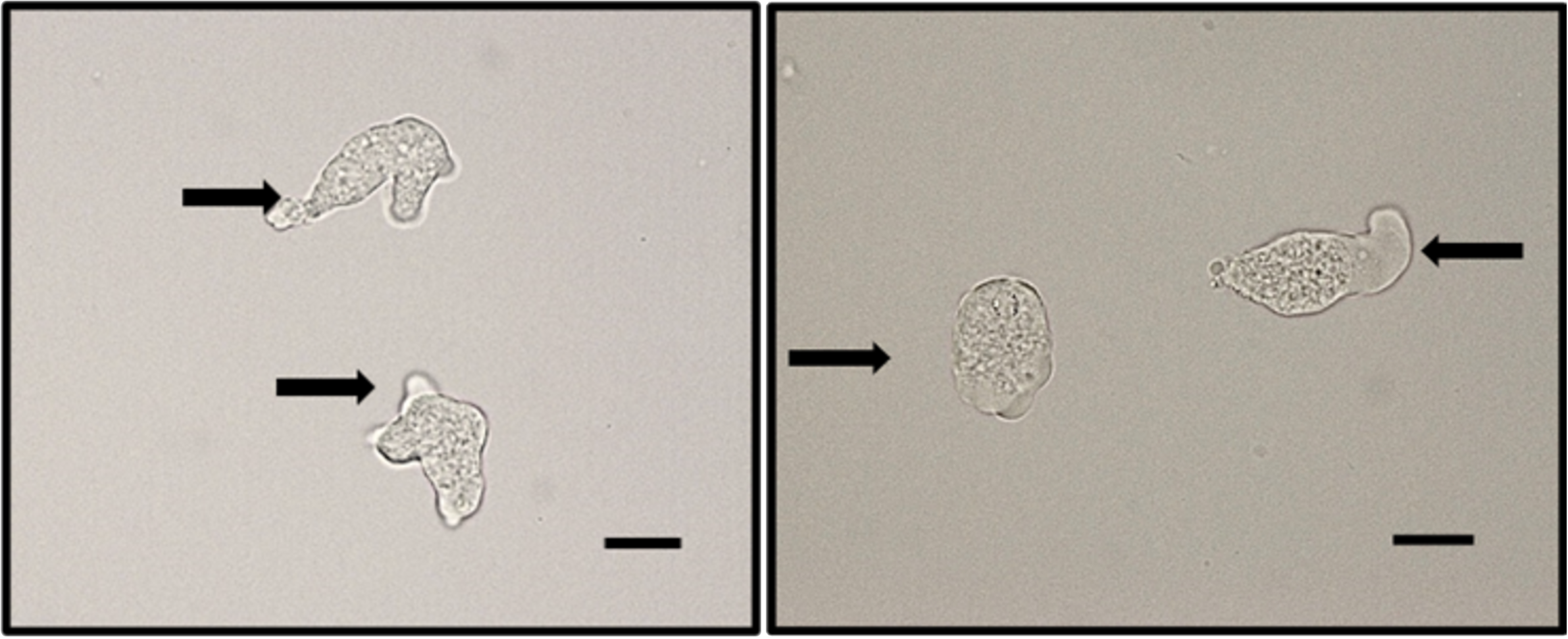
Amibas refringentes pleomórficas con proyección de pseudópodos (flechas) y citoplasma con vacuolas.
Barra=50 μm.
Fuente: elaboración propia.
Figura 2
Absceso hepático amibiano en hámster (aha)
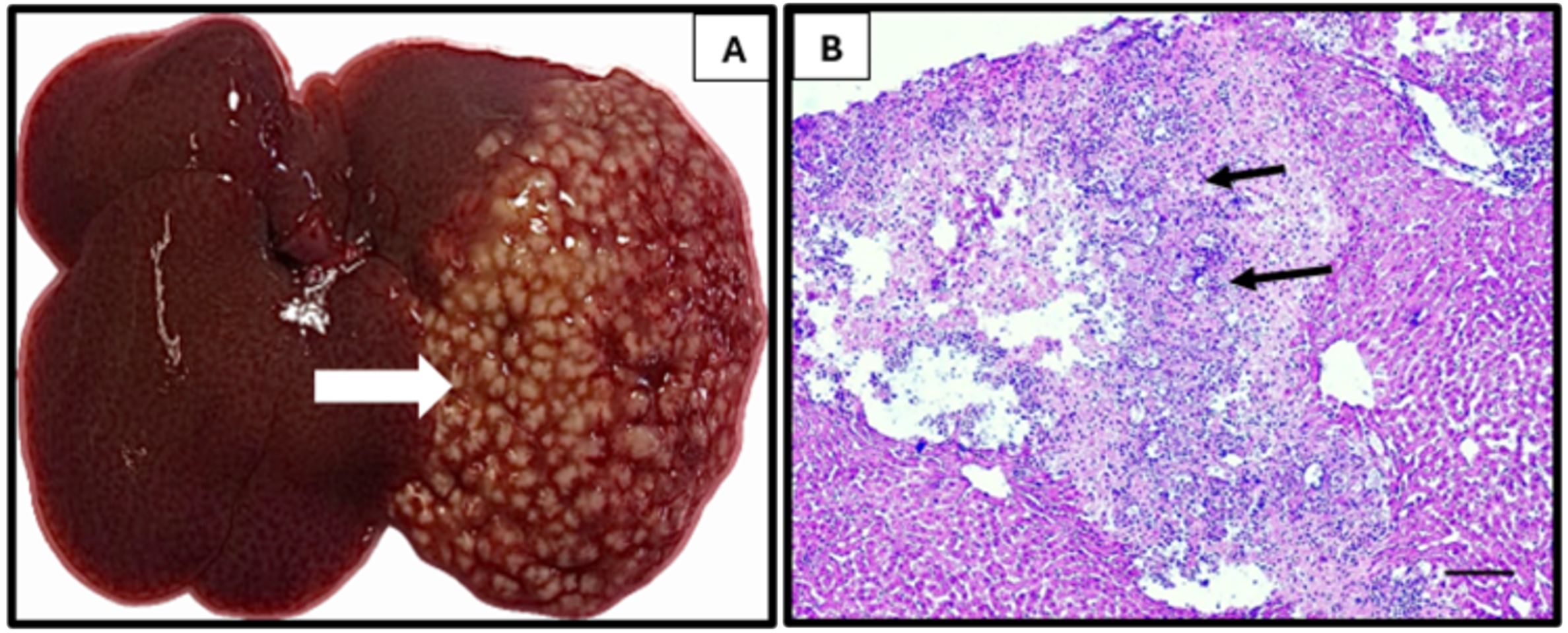
A. Aspecto macroscópico del absceso hepático amibiano (aha) a siete días de la postinfección en lóbulo izquierdo con lesión de aspecto grumoso (flecha blanca). B. Histología del aha (siete dias de evolución) en grandes extensiones de tejido
necrótico con la presencia de células inflamatorias, principalmente de tipo crónico y amibas (flechas negras).
Barra=50 μm.
Fuente: elaboración propia.
Desarrollo
Tratamiento
El tratamiento más utilizado contra la amibiasis son los nitroimidazoles. Por lo general, la dosis depende de la gravedad de la enfermedad, y aunque el metronidazol es el tratamiento estándar, puede causar efectos adversos cuando se da por periodos largos y en dosis altas, que van desde náuseas y vomito hasta encefalopatía hepática, enfermedad aguda o crónica del sistema nervioso central, falla hepática, entre otros.
Elizondo et al. (1996) realizaron un estudio para evaluar las frecuencias de aberración genética correlacionadas con el tratamiento con metronidazol en linfocitos de sangre humana, en el que se observó ruptura en las cromátidas de estas células; sin embargo, no hay datos bibliográficos que demuestren daño en el material genético de las células del humano, aunque se sabe que, al transformarse, este fármaco puede segmentar el material genético o generar ros. Al mismo tiempo, se ha observado que se generan metabolitos que muestran actividad mutagénica (Martínez et al., 2018).
La importancia de generar nuevos tratamientos que no tengan efectos tóxicos en el ser humano nos ha impulsado a evaluar compuestos recientes que sean accesibles y de bajo costo de procesamiento. El uso de plantas medicinales es una de las opciones más buscadas por muchos investigadores. Por mucho tiempo hemos dependido del uso de plantas como alimento o para el tratamiento de enfermedades. Existe abudante información al respecto gracias a nuestros antepasados, que contribuyeron a la medicina moderna. Además, al ser un recurso renovable que constantemente está en crecimiento, la diversidad de plantas nos permite tener acceso a estos compuestos en muchas regiones del mundo. Con el descubrimiento de biomoléculas terapéuticamente activas a través de la investigación de su estructura y función, la ciencia ha logrado avances en el tratamiento de diversas enfermedades (Mukherjee et al., 2015).
Figura 3
Estructura química de flavonoides
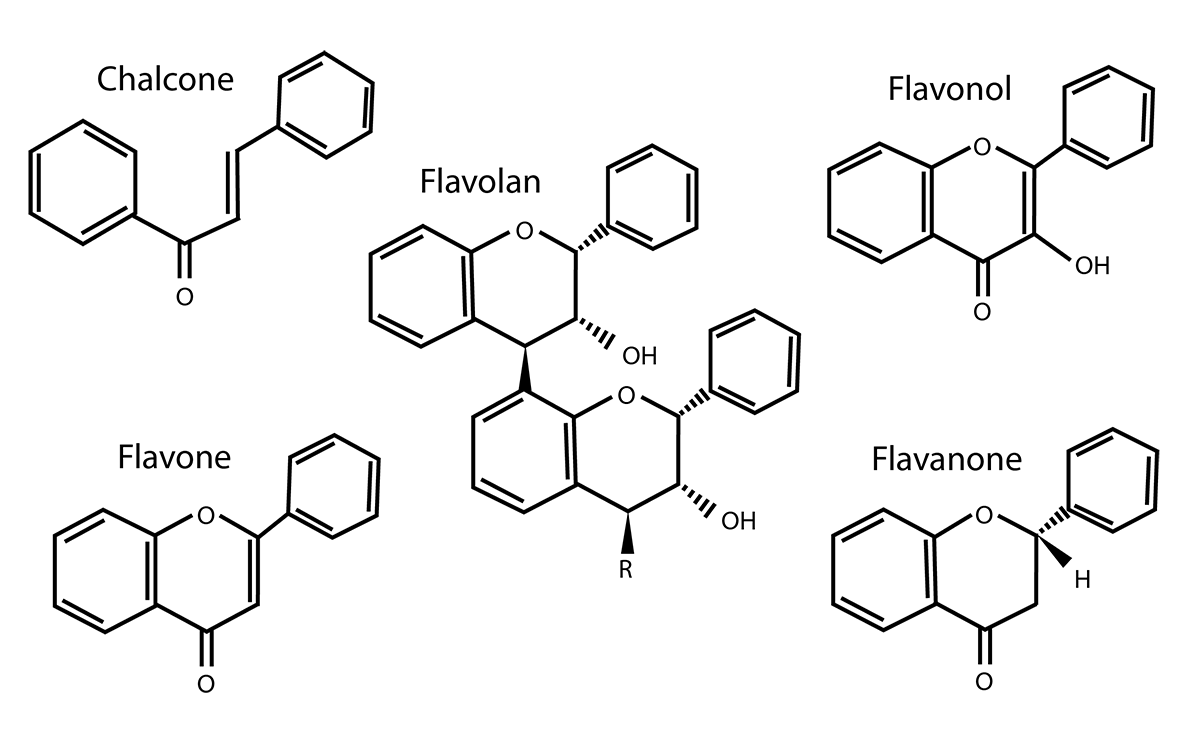
Fuente: tomado de Ku-Vera (2020).
Figura 4
Estructura molecular de camperol
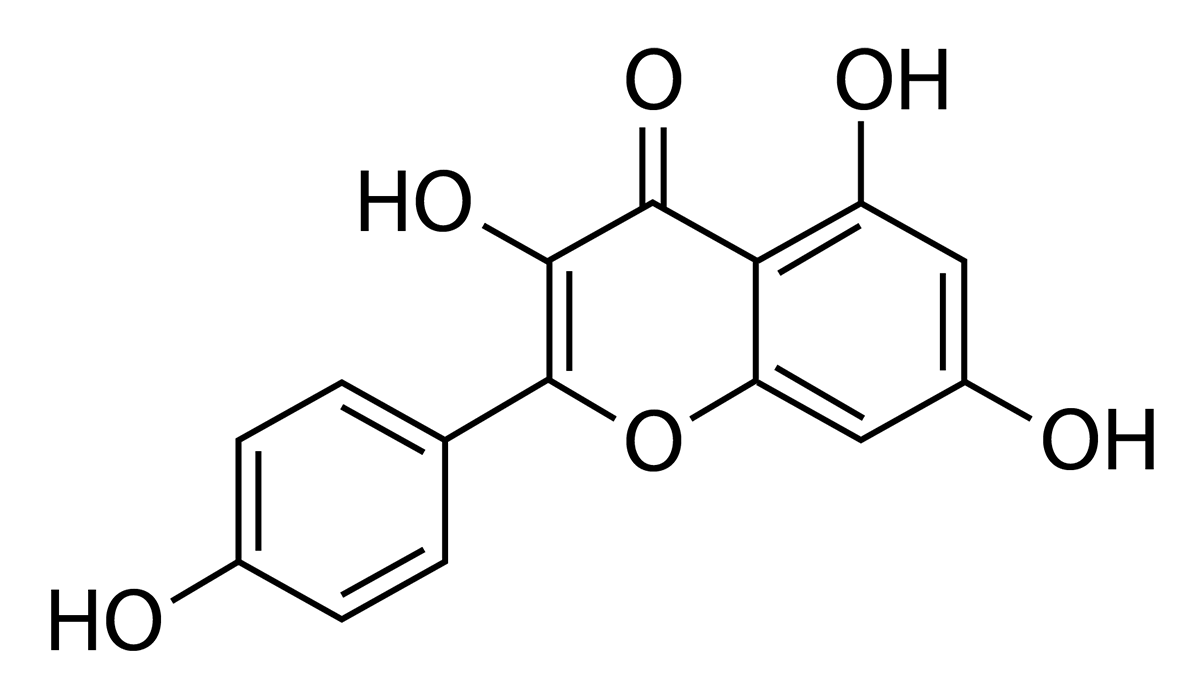
Fuente: tomado de Periferakis et al. (2022).
Importancia de los flavonoides en el tratamiento contra la amibiasis
Los flavonoides son compuestos que se encuentran en las hojas, tallos, frutos y flores de las plantas. Se han utilizado en las poblaciones prehispánicas de México, así como en la medicina tradicional china, y se sabe que estos compuestos tienen acción como antioxidantes, antinflamatorios, diuréticos, antiespasmódicos, antiulcerosos y reguladores del sistema inmunológico. La estructura química de los flavonoides está conformada por compuestos orgánicos con la presencia de un grupo fenol (alcohol) (figura 3). Tienen dos anillos aromáticos unidos entre sí por una cadena de tres carbonos ciclada a través de un oxígeno. Estos anillos de benceno están hidroxilados y llegan a tener un peso molecular bajo (500-4000 da) (López et al., 2002; Martínez et al., 2018).
La clasificación de estos compuestos se basa en la estructura molecular que presentan, ya sea por la posición y cantidad de radicales hidroxilo, formados por un átomo de hidrógeno y otro de oxígeno (-oh), o si muestran modificaciones del compuesto orgánico aromático. Dentro de los grupos más estudiados están las flavonas, flavonoles, flavanonas, chalcones e isoflavonoides, y existen compuestos que conservan la isoforma de un flavonoide pero carecen de un grupo carbonilo en la posición 4. Dentro de estos compuestos se encuentran las catequinas, antocianidinas, leucoantocianidinas y antocianósidos, los cuales también han mostrado funciones antiinflamatorias (López et al., 2002; Martínez et al., 2018).
La acción antioxidante de los flavonoides depende de su capacidad de reducir las ros y quelar metales, con lo cual se impiden algunas reacciones oxidativas. Aunado a esto, existen registros donde se ha observado que inhiben algunos procesos enzimáticos, como el del catecol o-metil transferasa, el sistema de transducción de señales de la membrana celular y de las enzimas que intervienen en los procesos de vascularización (Martínez et al., 2018).
La actividad antioxidante del flavonoide elimina las ros por donación directa de átomos de hidrógeno, y mediante eliminación de metales y una acción enzimática. A su vez, estos compuestos estimulan la inducción de diversas enzimas antioxidantes (Martínez et al., 2018).
Estudios previos han reportado que la epicatequina actúa sobre el citoesqueleto de la amiba a las 48 horas, ya que se observa una sobreexpresión de diferentes proteínas del citoesqueleto —red de proteínas que determinan la estructura de la célula—, lo cual afecta como cosecuencia la adhesión, migración y capacidad de daño de la amiba sobre la línea celular intestinal (Bolaños et al., 2014; Bolaños et al., 2015).
Por otro lado, Velázquez-Torres et al. (2021) demostraron in vivo que el flavonoide epicatequina disminuye el desarrollo del absceso hepático (aha) en concentraciones de 10mg/100g de peso. Además, el análisis histológico demostró un proceso de regeneración con la presencia de células del sistema inmune. Se observa una disminución de las células inmunitarias, aumento en el número de hepatocitos y en los vasos recién formados, así como la ausencia de amibas en el hígado del hámster, lo que indica que existe un fenómeno de reparación en la zona de la lesión, comparado con los grupos de control que fueron tratados con metronidazol o con aquellos animales que únicamente se inocularon con amibas para inducir el aha en el modelo del hámster (Tsutsumi et al., 1984) (figura 2). En este estudio también se determinó un efecto modulador sobre citocinas inflamatorias, como tnf-α, il-1β, y reguladoras, como la il-10. Los autores concluyen que el flavonoide epicatequina puede contribuir a la resolución del aha (Velásquez-Torres et al., 2021).
Se han realizado estudios que exploran la acción de algunos flavonoides, como el camperol, sobre trofozoítos de E. histolytica (figura 4). Esta molécula se compone de quince carbonos, y en ella el puente de tres carbonos entre los grupos fenilo, formados por seis átomos de carbono c y cinco átomos de hidrógeno h, se cierra con el oxígeno para formar un flavonol, el cual presenta una acción antiinflamatoria (Periferakis et al., 2022).
Levaro-Loquio et al. (2023) demostraron el efecto del camperol sobre la viabilidad amibiana con una concentración de 150 mm a 90 min de exposición, comparado con los trofozoítos tratados con metronidazol en la misma concentración y tiempos de exposición. También se detectó una sobreexpresión de proteínas, particularmente de una proteína de 67 kda de E. histolytica. Mediante ensayos de biología molecular se observó una regulación negativa en la expresión de genes de enzimas amibianas antioxidantes. Además, se demostró una disminución en la actividad de una enzima prooxidante, como la mieloperoxidasa (mpo), y en la producción de no y ros del neutrófilo, al ser interaccionado con amibas en presencia del flavonoide camperol (Levaro-Loquio et al., 2023).
En el aha experimental se presenta un ambiente prooxidativo generado por la respuesta inflamatoria exacerbada que monta el huésped ante la amiba. Este ambiente podría ser controlado por los flavonoides, que tienen un efecto directo sobre los trofozoítos de E. histolytica, al dañar el citoesqueleto, desregular las enzimas amibianas antioxidantes y glucolíticas, así como alterar el ácido desoxirribonucleico que contiene el material genético amibiano (adn); además, induce apoptosis en la amiba y actúa como un antioxidante, lo cual favorece la disminución del porcentaje de aha (Bolaños et al., 2014; Bolaños et al., 2015; Levaro-Loquio et al., 2023; Velásquez-Torres et al., 2021; Velázquez-Domínguez et al., 2020).
Conclusiones
Los resultados del uso de flavonoides son alentadores y en el futuro podrían ser evaluados a través de preclínica, como un fármaco eficaz contra la amibiasis, y convertirse en un mejor tratamiento contra esta patología.
Referencias
Atias, A. M. (2011). Parasitología médica. Editorial Mediterraneo.
Bolaños, V., Díaz-Martínez, A., Soto, J., Marchat, L. A., Sanchez-Monroy, V. y Ramírez-Moreno, E. (2015). Kaempferol inhibits Entamoeba histolytica growth by altering cytoskeletal functions. Molecular and Biochemical Parasitology, (1), 16-25. https://doi.org/10.1016/j.molbiopara.2015.11.004
Bolaños, V., Díaz-Martínez, A., Soto, J., Rodríguez, M. A., López-Camarillo, C., Marchat, L. A. y Ramírez-Moreno, E. (2014). The flavonoid (-)-epicatechin affects cytoskeleton proteins and functions in Entamoeba histolytica. Journal of Proteomics, 111, 74-85. https://doi.org/10.1016/j.jprot.2014.05.017
Bruckner, D. A. (1992). Amebiasis. Clinical Microbiology Reviews, 5(4), 356-369. https://doi.org/10.1128/cmr.5.4.356
Elizondo, G., Gonsebatt, M. E., Salazar, A. M., Lares, I., Santiago, P., Herrera, J., Hong, E. y Ostrosky-Wegman, P. (1996). Genotoxic effects of metronidazole. Mutation Research/Genetic Toxicology, 370(2), 75-80. https://doi.org/10.1016/0165-1218(96)00022-5
Guillén, N. (2023). Pathogenicity and virulence of Entamoeba histolytica, the agent of amoebiasis. Virulence, 14(1), 2158656. https://doi.org/10.1080/21505594.2022.2158656
Ku-Vera, J. C., Jiménez-Ocampo, R., Valencia-Salazar, S. S., Montoya-Flores, M. D., Molina-Botero, I. C., Arango, J., Gómez-Bravo, C. A., Aguilar-Pérez, C. F. y Solorio-Sánchez, F. J. (2020). Role of secondary plant metabolites on enteric methane mitigation in ruminants. Frontiers in Veterinary Science, 7, 1-14. https://doi.org/10.3389/fvets.2020.00584
Levaro-Loquio, D., Serrano-Luna, J., Velásquez-Torres, M., Higuera-Martínez, G., Arciniega-Martínez, I. M., Reséndiz-Albor, A. A., Pérez-Vielma, N. M. y Pacheco-Yépez, J. (2023). In vitro evaluation of the antiamoebic activity of kaempferol against trophozoites of Entamoeba histolytica and in the interactions of amoebae with hamster neutrophils. International Journal of Molecular Sciences, 24(13), 1-15. https://doi.org/10.3390/ijms241311216
López Luengo, M. T. (2002). Flavonoides. offarm. Farmacia y Sociedad, 21(4), 108-114.
Martínez-Castillo, M., Pacheco-Yépez, J., Flores-Huerta, N., Guzmán-Téllez, P., Jarillo-Luna, R. A., Cárdenas-Jaramillo, L. M., Campos-Rodríguez, R. y Shibayama, M. (2018). Flavonoids as a Natural Treatment Against Entamoeba histolytica. Frontiers Cellular and Infection Microbiology, 8, 1-19. https://doi.org/10.3389/fcimb.2018.00209
Mukherjee, J. (ed.) (2015). Biotechnological Applications of Biodiversity. Springer (Serie Advances in Biochemical Engineering/Biotechnology 147, T. Scheper ed.). https://doi.org/10.1007/978-3-662-45097-0
Nakada-Tsukui, K. y Nozaki, T. (2016). Immune response of amebiasis and immune evasion by Entamoeba histolytica. Frontiers in Immunology, 7, 1-13. https://doi.org/10.3389/fimmu.2016.00175
Olivos-García, A., Saavedra, E., Ramos-Martínez, E., Nequiz, M. y Pérez-Tamayo, R. (2009). Molecular nature of virulence in Entamoeba histolytica. Infection, Genetics and Evolution, 9(6), 1033-1037. https://doi.org/10.1016/j.meegid.2009.04.005
Organización Panamericana de la Salud (2020). Medios auxiliares para el diagnóstico de las parasitosis intestinales (2ª ed.). ops. https://www.paho.org/es/documentos/medios-auxiliares-para-diagnostico-parasitosis-intestinales
Pacheco-Yépez, J., Rivera Aguilar, V., Barbosa Cabrera, E., Rojas Hernández, S., Jarillo-Luna, R. A. y Campos Rodríguez, R. (2011). Myeloperoxidase binds to and kills Entamoeba histolytica trophozoites. Parasite Immunol, 33(5), 255-264. https://doi.org/10.1111/j.1365-3024.2010.01275.x
Periferakis, A., Periferakis, K., Badarau, J. A., Petran, E. M., Popa, D. C., Caruntu, A., Costache, R. S., Scheau, C., Caruntu, C. y Costache, D. O. (2022). Kaempferol: antimicrobial properties, sources, clinical, and traditional applications. International Journal of Molecular Sciences, 23(23), 1-39. https://doi.org/10.3390/ijms232315054
Tsutsumi, V., Mena-López, R., Anaya-Velázquez, F. y Martínez-Palomo, A. (1984). Cellular bases of experimental amebic liver abscess formation. The American Journal of Pathology, 117(1), 81-91. https://pmc.ncbi.nlm.nih.gov/articles/PMC1900566/
Velásquez-Torres, M., Shibayama-Salas, M., Pacheco-Yépez, J., Silva-Olivares, A., Sánchez-Monroy, V., Marchat, L. A., Rivera, G. y Ramírez-Moreno, E. (2021). (-)-Epicatechin protects from amebic liver abscess development in hamster. Experimental Parasitology, 224, 1-9. https://doi.org/10.1016/j.exppara.2021.108103
Velázquez-Domínguez, J. A., Hernández-Ramírez, V. I., Calzada, F., Varela-Rodríguez, L., Pichardo-Hernández, D. L., Bautista, E., Herrera-Martínez, M., Castellanos-Mijangos, R. D., Matus-Meza, A. S., Chávez-Munguía, B. y Talamás-Rohana, P. (2020). Linearolactone and kaempferol disrupt the actin cytoskeleton in Entamoeba histolytica: inhibition of amoebic liver abscess development. Journal of Natural Products, 83(12), 3671-3680. https://doi.org/10.1021/acs.jnatprod.0c00892
Vidal Vademecum Spain (julio de 2022). Metronidazol Normon 250 mg Comprimidos efg. Vademecum. https://www.vademecum.es/espana/prospecto/21361/metronidazol-normon-250-mg-comprimidos-efg