Inventio
Vol. 20, núm. 52, 2024
doi: https://doi.org/10.30973/inventio/2024.20.52/9
Fluoruro en el agua: efectos en la salud y métodos de detección y remoción
Fluoride in water: health effects and methods of detection and removal
Nancy Lara Sánchez
orcid: 0000-0001-7849-3114, nancy.laras@alumno.buap.mx
Doctorado en Ciencias Químicas, Centro de Química (cq), Instituto de Ciencias (ic), Benemérita Universidad Autónoma de Puebla (buap)
Armando Ramírez Monroy
orcid: 0000-0002-7245-7822, armando.ramirez@correo.buap.mx
Centro de Química (cq), Instituto de Ciencias (ic), Benemérita Universidad Autónoma de Puebla (buap)
Maribel Arroyo Carranza
orcid: 0000-0001-7264-9309, sandra.arroyo@correo.buap.mx
Centro de Química (cq), Instituto de Ciencias (ic), Benemérita Universidad Autónoma de Puebla (buap)
resumen
Es crucial conocer la concentración de fluoruro (f¯) en las diferentes fuentes que afectan a los seres vivos debido a sus efectos positivos y negativos. El f¯, uno de los componentes de la pasta de dientes, resulta beneficioso al prevenir las caries, el deterioro del esmalte dental y el proceso de remineralización. Su exceso puede causar daños a la salud y, en concentraciones muy elevadas, incluso la muerte. Este ion puede contaminar el agua y la cadena alimentaria, por lo que la detección y medición eficiente de su contenido en los consumibles es esencial. Se plantea el problema de las altas concentraciones de f¯ y se analizan los métodos utilizados para su detección, cuantificación y remoción.
palabras clave
fluoruro, sensores, detección, remoción, límites permitidos, salud, agua
abstract
It is crucial to know the concentration of fluoride (f¯) in the different sources that affect living beings due to its positive and negative effects. f¯, one of the components of toothpaste, is beneficial by preventing cavities, the deterioration of tooth enamel and the remineralization process. Its excess can cause health damage and, in high concentrations, even death. This ion can contaminate water and the food chain, therefore, the efficient detection and measurement of its content in consumables is essential. In this review, we pointed out the problem of high concentrations of f¯ and analyzed the methods used for its detection, quantification and removal.
key words
fluoride, sensors, detection, elimination, permitted limits, health, water
Recepción: 01/04/24. Aceptación: 21/08/24. Publicación: 07/03/25.
Introducción
El flúor (f) es el elemento químico más ligero de los halógenos y el más electronegativo de los elementos de la tabla periódica. Existe como moléculas diatómicas (f2) en su estado elemental (puro) y es un gas amarillo altamente tóxico y extremadamente reactivo, capaz de reaccionar con facilidad —en algunos casos de forma explosiva— con casi todos los demás elementos químicos y con muchos compuestos. Incluso algunas sustancias que se caracterizan por “no ser reactivas”, como el acero, el vidrio y las fibras de asbesto, reaccionan en frío con este elemento; el agua y la madera se incendian espontáneamente bajo una corriente de este gas (Jaccaud et al., 2000). En la Tierra, este elemento ocupa el decimotercer lugar en abundancia (Chang, 2007), y no se encuentra en estado elemental sino formando parte de muchos compuestos en su forma de ion fluoruro (f¯), es decir, como el átomo de flúor con un electrón adicional, lo que modifica de manera drástica su reactividad. Por lo tanto, la exposición al flúor ocurre con normalidad cuando éste se encuentra en su forma iónica de f¯ (Jiménez-Ángeles et al., 2023).
En la naturaleza, el flúor se encuentra formando parte de diversos minerales y como sales de f¯ disueltas en el agua, el suelo y en algunos alimentos. El exceso de f¯ en las aguas subterráneas es un problema que afecta de manera significativa varias regiones en América Latina (Argentina, Bolivia, Chile, Colombia, México, Perú) (Alarcón-Herrera et al., 2013), Asia (China, India, Japón, Corea) (Committee on Fluoride in Drinking Water et al., 2006; World Health Organization, 2023) y África (Etiopía, Ghana, Nigeria, Tanzania) (Mahlangu et al., 2012).
De manera particular, las zonas áridas y semiáridas de la región norte-central de México son comúnmente afectadas por arsénico (As) y flúor (f), que se asocian en el agua subterránea, y ambos contaminantes generan una problemática de salud para los seres vivos (Gutiérrez y Alarcón-Herrera, 2022; Navarro et al., 2017), al exponer a las personas a niveles altos de f¯ y As (Alarcón-Herrera et al., 2020). Las fuentes están vinculadas a fragmentos de rocas volcánicas félsicas, como el granito, que se encuentran en Texas (Scanlon et al., 2009), Chihuahua (Gutiérrez et al., 2021), Zacatecas (Ortiz Letechipia et al., 2022) y Jalisco (Ortega-Guerrero, 2009), así como a minerales secundarios, como las arcillas y oxihidróxidos de hierro, presentes en suelos aluviales de acuíferos.
Para trazar la distribución geográfica del flúor en México y estimar qué tanto la población está expuesta a niveles nocivos de éste, en 2017 se realizaron mediciones en agua potable en 3,951 sitios del país (Alarcón-Herrera et al., 2020), que confirman que el f¯ afecta sobre todo los estados de Durango, San Luis Potosí, Chihuahua, Zacatecas y Jalisco, y que las altas concentraciones de compuestos de As a menudo muestran una relación directa con altas concentraciones de f¯.
Actualmente, el f¯ se añade a pastas dentales y enjuagues bucales, ya que puede ayudar a prevenir la caries dental. Sin embargo, la exposición excesiva al f¯ puede ocasionar problemas de salud, como fluorosis, urolitiasis, reducción en las capacidades cognitivas de la población infantil, alzheimer e incluso la muerte (Rocha et al., 2013). Lo que resulta alarmante es que varios estudios de la concentración de f¯ en aguas de pozo, grifo y embotelladas en México muestran concentraciones muy superiores a las permitidas por las normas oficiales.
Otro estudio llevado a cabo por la Red Nacional de Medición de la Calidad del Agua (renameca) de 2012 a 2020 analizó 2,064 pozos a lo largo de la República mexicana y encontró que un 17% presentaba concentraciones de f¯ superiores a las permitidas por las normas oficiales (Comisión Nacional del Agua [conagua], 2022). En el mapa (figura 1) se muestran en color amarillo los pozos de agua potable con concentraciones bajas de f¯, que van de 0 a < 0.4 mg/l; en color verde, aquellos con concentraciones de 0.4 a < 0.7 mg/l; en azul, los de concentraciones de 0.7 a < 1.5 mg/l, y en rojo, aquellos con concentraciones de f¯ > 1.5 mg/l, los cuales incumplen la norma y representan potenciales implicaciones en la salud. Cabe destacar que en México los principales yacimientos de producción de fluorita están localizados en los estados de San Luis Potosí (96%) y Coahuila (2%), seguidos por Durango (1%) y Guanajuato (1%) (Dirección General de Desarrollo Minero, 2021).
Figura 1
Concentración de iones f¯ en pozos de agua en la República mexicana
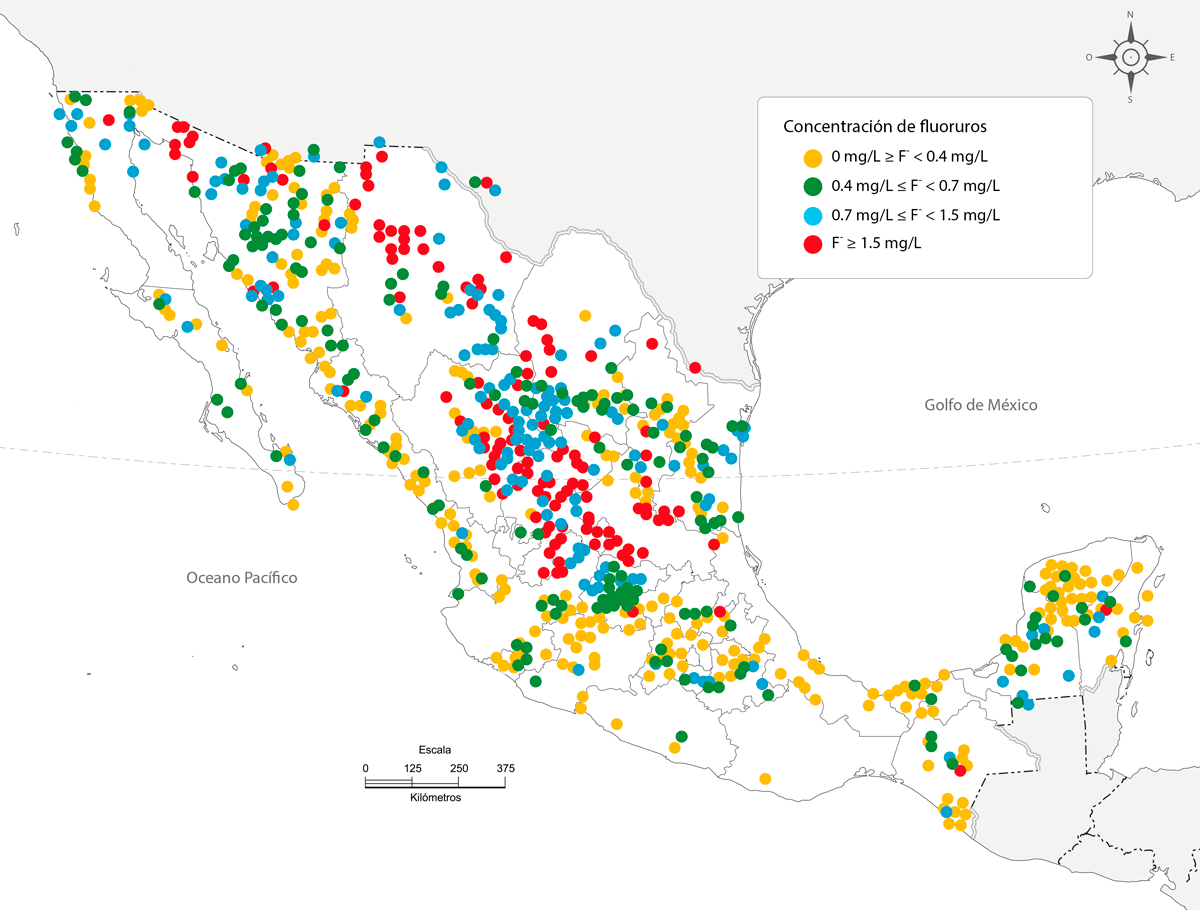
Fuente: elaboración propia.
Principales fuentes de fluoruro en la naturaleza
El enriquecimiento de f¯ está relacionado con los acuíferos de aluvión, que son sedimentos transportados por ríos y depositados en llanuras debido a procesos geológicos y químicos (Morales-Simfors et al., 2020). Estudios para la zona norte y áreas geotermales de México han encontrado que las principales fuentes de f¯ en agua subterránea son de origen geogénico, en rocas de criolita, piedras de cal, rocas sedimentarias, así como fluorapatitas en rocas ígneas y metamórficas (Apambire et al., 1997).
Los fluoruros contaminantes se asocian principalmente con la descomposición de rocas volcánicas ácidas (formadas por la solidificación del magma), con más de 60% de sílice (sio2), y con las emisiones volcánicas en forma de gases que ingresan al aire. Los minerales más comunes que contienen f¯ en la corteza terrestre son fluorita (caf2), fluorapatita [ca5(po4)3f], biotita [k(mg,fe)3(alsi3o10)(oh,f)] y flogopita [kmg3(alsi3o10)(f,oh)]. Las interacciones entre el agua y las rocas causan la lixiviación de minerales que contienen f¯, lo que conduce a su concentración en el agua subterránea. La reacción química para la disolución de la fluorita (caf2) en aguas subterráneas con alto contenido de bicarbonato (hco3−) se expresa de la siguiente manera (Vithanage y Bhattacharya, 2015):
caf2 + 2hco3− → caco3 + 2f¯ + co2 + h2o
En esta reacción, el ion bicarbonato se combina con la fluorita para formar carbonato de calcio (caco3), iones f¯, dióxido de carbono (co2) y agua (h2o). El contenido de hco3− en el agua subterránea, junto con un alto valor de ph y alto contenido de iones sodio (na+), puede influir en la disolución de la fluorita aumentando la concentración de f¯ en el agua. Esto se debe a que las condiciones alcalinas y la conductividad específica moderada favorecen la disolución de la fluorita en las rocas y la consecuente liberación de iones f¯ al agua. En aguas subterráneas con alto contenido de hco3−, na+ e iones hidróxido (oh¯), este ion puede reemplazar al f¯ intercambiable presente en algunos minerales, lo que aumenta el contenido de f¯ en el agua subterránea. La reacción química involucrada de la muscovita fluorada, kal2(alsi3o10) f2, para formar la muscovita hidroxilada kal2(alsi3o10)(oh)2 (Vithanage y Bhattacharya, 2015) es la siguiente:
kal2(alsi3o10)f2 + 2oh¯ → kal2(alsi3o10)(oh)2 + 2f¯
Además de las fuentes geogénicas, existen fuentes antropogénicas de f¯. Éstas incluyen descargas de industrias que procesan o generan aluminio, fosfatos, carbón, fertilizantes, cerámica, acero, petróleo, vidrio, semiconductores, entre otros. La incineración de residuos municipales que contienen compuestos fluorados, como plásticos y textiles, así como la descomposición de caf2 en lodos de desecho, también pueden generar emisiones de ácido fluorhídrico (hf) y contribuir a la acumulación de iones f¯ en el agua (Kumar et al., 2024). Si bien existen estas fuentes antropogénicas de f¯, es importante destacar que la contaminación de las aguas subterráneas por f¯ se debe sobre todo a fuentes geogénicas.
Límites permisibles de fluoruro
La Organización Mundial de la Salud (oms) recomienda, para el f¯ en el agua potable, un valor máximo de 1.5 mg/l, mientras que la Norma Oficial Mexicana nom-127-ssa1-2021 establece 1.0 mg/l para todas las localidades del país, es decir, es un poco más estricta que la norma de la oms. Estos valores de referencia fueron establecidos porque se ha comprobado que las concentraciones superiores conllevan un riesgo de fluorosis dental y las concentraciones muy altas conducen a riesgos de fluorosis esquelética. Cabe mencionar que el valor para la fluoración artificial de agua potable va de 0.5 a 1.0 mg/l; sin embargo, en algunas zonas que no cuentan con el servicio, el agua de pozo que se consume puede presentar concentraciones mucho más altas de 10 mg/l.
En México, a pesar de las normas establecidas, en 2013 el análisis de agua embotellada de diferentes marcas mostró que los estados de Colima y Durango presentaban concentraciones de 3.1 mg/l y 2.2 mg/l, respectivamente (Cruz Cardoso et al., 2013), y una revisión bibliográfica sistemática hasta 2021 de la concentración de f¯ en aguas de pozo, grifo y embotelladas en diferentes estados del norte y occidente de México mostró un incremento de hasta 8.4 mg/l en el estado de Durango (Vázquez-Bojórquez et al., 2022).
En otro estudio se encontró un intervalo de concentraciones de f¯ de 0.03 a 27.9 mg/l, donde 52%, 45% y 36% de las muestras estudiadas estaban por encima del límite establecido por norma para los estados de Zacatecas, Chihuahua y Durango, respectivamente (Gutiérrez y Alarcón-Herrera, 2022). En 2020, en Jalisco, se encontró que, de 49 pozos estudiados, el 25% presentaba concentraciones de fluoruros de hasta 13.27 mg/l (Castañeda Villanueva, 2020). Y en Guanajuato, en 2023, se demostró que la población de Praderas de la Venta consumía agua potable con un alto contenido de f¯ de hasta 7.1 mg/l (Morales-Arredondo et al., 2022).
Fuentes principales de fluoruro para el ser humano
Las principales fuentes de exposición humana al f¯ se encuentran en el agua, los alimentos y en productos dentales, aunque también pueden originarse por inhalación y contacto con la piel (Sawangjang y Takizawa, 2023).
Prácticamente todos los alimentos contienen al menos trazas de f¯ y toda la vegetación contiene f¯ que se absorbe del suelo y del agua. En el té seco, la concentración promedio de f¯ es de 100 mg/kg (World Health Organization [who], 2023). En 2023 se publicó un análisis de f¯ en diferentes especies de arroz y vegetales cuando se remojan en agua fluorada de manera artificial, donde se encontró, por una parte, que la concentración de f¯ disminuyó en el agua de remojo después del remojo y, por otra parte, al aumentar la temperatura del agua de 25° c a 100° c, el contenido de f¯ aumentó 3.8-5.1 veces en el arroz y 2.0-12.2 veces en las verduras, cuando se tienen 1.5 mg/l de concentración de f¯ en el agua inicial para el remojo. Esto demuestra que la proporción de ingesta de f¯ a partir de los alimentos podría ser variable y hasta muy alta, según el alimento, la temperatura de cocción y la concentración original de f¯ en el agua de cocción, debido a que estos alimentos acumulan f¯ por adsorción y absorción (Sawangjang y Takizawa, 2023).
En 2020 se realizó un estudio de productos dentales con 117 muestras donde se encontraron concentraciones de 18412 ± 0.009 mg/kg de f¯ en el dentífrico para niños y de 2703 ± 38.4 mg/l en colutorios o enjuagues bucales. La cantidad de f¯ en pastas dentales recomendada para adultos es de 1450 y 2500 mg/f, y aquellas con niveles inferiores no son recomendadas debido a la posible pérdida de su función anticariogénica. En el mismo estudio, los dentífricos infantiles contienen entre 561 y 18412 mg/kg, cantidades muy elevadas para los niños, que son el principal grupo de riesgo en cuanto a la ingestión accidental de dentífricos y colutorios.
Se estima que, para desarrollar fluorosis, un niño debe ingerir entre 0.03 y 0.1 mg/kg de f¯ en cada cepillado. La recomendación en este caso es apegarse a la normativa del contenido de f¯ en pastas dentales infantiles y considerar los riesgos de su uso. En cuanto a los colutorios, existen dos tipos: los de uso diario (225 mg/kg) y los de uso semanal (900 mg/kg), por lo que se recomienda que los colutorios se encuentren en este intervalo (Javier Pérez et al., 2020).
Normalmente, los fluoruros se encuentran en cantidades muy pequeñas en el aire (1 μg/m3); sin embargo, el aire alrededor de vertederos de residuos peligrosos o fábricas de textiles y metales o de producción de petróleo y carbón, que utilizan o producen ácido fluorhídrico (hf) o compuestos fluorados, puede contener altos niveles de estas sustancias y los trabajadores podrían estar expuestos a niveles elevados de hf o criolita (na3alf6) en el aire y respirar hasta 2.5 mg/m3 de aire fluorado.
Cuando se respira aire que contiene flúor, éste puede entrar en el torrente sanguíneo a través de los pulmones, pero una gran parte del flúor sale del organismo a través de la orina y otra parte se almacena en los huesos y dientes. Por otro lado, cuando el hf entra en contacto con la piel, la mayor parte pasa rápidamente a la sangre y se almacena también en los huesos y dientes. La inhalación aguda de hf tras salpicaduras faciales puede causar ulceración bronquiolar, hemorragia, edema pulmonar y, finalmente, la muerte. El principal efecto en la salud por la exposición crónica al f¯ por inhalación es la fluorosis esquelética (us Department of Health & Human Services et al., 1993).
Fluoruro en regiones específicas de México
En estudios realizados en varios estados de México se ha encontrado una preocupante prevalencia de concentraciones elevadas de f¯ en el agua potable, que con frecuencia exceden los límites máximos permitidos, lo que representa serios riesgos para la salud de las poblaciones locales.
En Durango se detectaron niveles altos de f¯ en todas las regiones estudiadas (Molina Frechero et al., 2013), con la mayor concentración en la región norte, lo cual afecta la calidad del agua embotellada (Martínez-Prado et al., 2013). Un 90% de pozos y depósitos en el Valle del Guadiana excedió los límites normativos, lo que se vincula con casos de fluorosis en la población (García-Montiel et al., 2023). Chihuahua reveló una exposición conjunta a As y f¯, con una significativa porción de muestras de agua y orina que superaban los estándares de seguridad (González-Horta et al., 2015). Zacatecas mostró variaciones regionales en las concentraciones de f¯, donde se destacan en especial las zonas semicálidas secas y semisecas (Morales de Avila et al., 2023).
De igual forma, en San Luis Potosí se observó una correlación entre la severidad de la fluorosis dental y la concentración de f¯ encontrada en orina, lo cual indica un efecto acumulativo de exposición (Jarquín-Yáñez et al., 2015). Jalisco enfrenta un desafío particular en la región de los Altos, donde la faja volcánica transmexicana ha enriquecido las fuentes de agua subterránea con f¯, lo que ha impactado de forma negativa en la salud pública (Hurtado y Gardea-Torresdey, 2004); incluso se ha sugerido un efecto adverso en la inteligencia no verbal por el aumento en la concentración de f¯ en el agua (Valdez-Jiménez et al., 2023). Estos hallazgos subrayan la necesidad urgente de medidas regulatorias y de mitigación para proteger a las comunidades afectadas.
Tabla 1
Influencia en la salud del ser humano según la concentración de fluoruro
| Concentración (mg/l) | Exposición | Efectos fisiológicos | Referencia |
| 0.05 - 0.07 | Ingesta habitual en el agua | Minimiza el riesgo de fluorosis dental | Hattab, 2020 |
|---|---|---|---|
| 0.25-0.6 | Aplicación controlada sobre los dientes | Protección contra fluorosis del esmalte dental | Clark et al., 2020 |
| > 1 | Ingesta habitual en el agua | Deterioro del metabolismo de la glucosa en animales y humanos | Zhou et al., 2023 |
| 1.5 | Ingesta habitual en el agua | Resistencia a la insulina y fluorosis dental | Vélez-León et al., 2019 |
| > 4 | Ingesta habitual en el agua | Fluorosis dental e hipomineralización del esmalte dental | Sosa-Soto et al., 2022 |
| 100-200 | Ingesta habitual en el agua | Aumento de riesgo de padecer alzheimer | Ghosh y Ghosh, 2020 |
| 200-400 | Ingesta habitual en el agua | Aumento crónico de niveles de hormonas que controlan el desarrollo de óvulos, espermatozoides y el funcionamiento sexual Disminución de niveles de testosterona y hormonas tiroideas |
Skórka-Majewicz et al., 2020 |
| 9000 | Dosis aguda | Muerte | Wallace Walser iii, 2021 |
Fuente: elaboración propia.
Daños a la salud
Conforme la concentración de f¯ aumenta en el cuerpo humano aumentan los efectos nocivos en la salud, de lo cual resultan efectos fisiológicos negativos según la concentración de f¯ ingerido (tabla 1).
En 2023 se publicó una revisión acerca de los problemas de salud por exposición a altos niveles de f¯ en niños, desde la gestación hasta los 18 años, expuestos a cualquier fuente de f¯, donde fueron empleadas pruebas oficiales de cociente de inteligencia (iq). Esta revisión sugiere que una alta exposición al f¯ en un nivel de más de 2 mg/l en el agua potable consumida de manera continua puede dar como resultado deficiencia cognitiva entre los niños (Gopu et al., 2023).
Es importante resaltar que la mayoría de los países regulan la cantidad de f¯ en los suministros públicos de agua para asegurar que se mantenga dentro de niveles seguros. Además, seguir las pautas recomendadas para usar productos dentales que contienen f¯ puede ayudar a minimizar el riesgo de exposición excesiva. No obstante, el consumo de alimentos como arroz y verduras que fueron cocinados con agua que contiene f¯ incrementa su concentración en el organismo (vide supra), lo cual es potencialmente peligroso, además de que es difícil establecer los valores de consumo en la población.
Figura 2
Detección de f¯ con naranja de xilenol sobre ncs ceria@zirconia
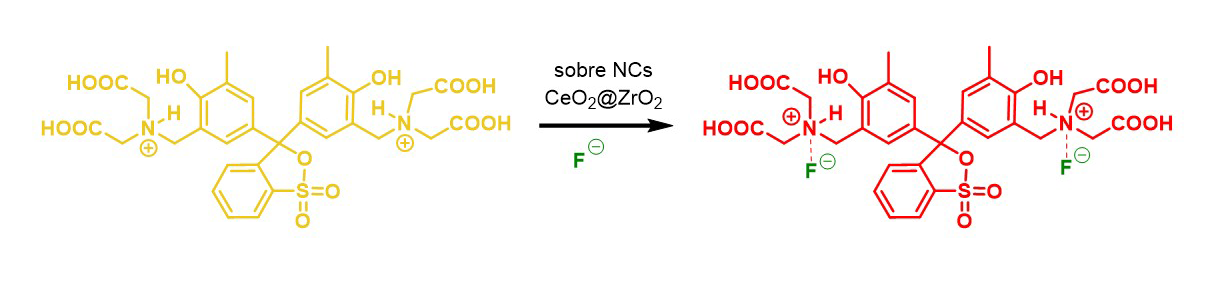
Fuente: elaboración propia.
Figura 3
Interacción de f¯ con sensor basado en cumarina
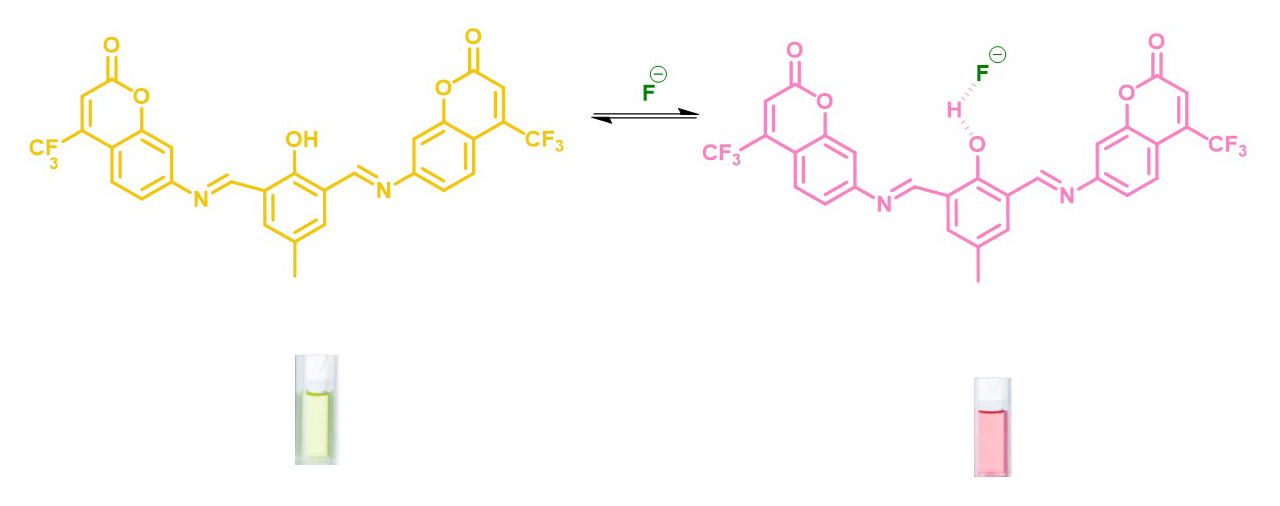
Fuente: elaboración propia.
Detección y cuantificación de iones fluoruro
Tradicionalmente el análisis de aniones f¯ se realiza mediante espectroscopía de rmn de 19f; sin embargo, la nom-aa-077-scfi-2001 establece dos métodos de prueba para la determinación de f¯ en agua. El método espectrofotométrico, basado en la reacción entre los iones f¯, y el complejo colorido Zirconilo-spadns [sal trisódica del ácido 1,8-dihidroxi-2-(4-sulfofenilazo) naftaleno-3,6-disulfónico], útil en el intervalo de 0 mg/l a 1.4 mg/l. En este método, el f¯ reacciona con el Zirconilo en medio ácido formando otro anión complejo incoloro (zrf62¯), y al aumentar el contenido de f¯ en la muestra la intensidad del color disminuye, donde la absorbancia es inversamente proporcional a la concentración de f¯.
El otro es el método potenciométrico, donde el f¯ se determina con un electrodo selectivo específico para ion f¯, el cual contiene una membrana cristalina de fluoruro de lantano (laf3). En este método, el estado iónico de la muestra crea una carga en la superficie de la membrana, en las dos interfases. La magnitud de la carga depende de la concentración de ion f¯ en la disolución. Así, el lado de la membrana con una concentración de ion f¯ más baja se vuelve positivo con respecto a la otra superficie. Esta diferencia de carga es la que proporciona una medida de la diferencia de concentración de f¯ en las dos disoluciones, útil en el intervalo de 0.1 mg/l a 10 mg/l.
También se han desarrollado métodos alternativos de análisis, como los quimiosensores específicos, que son útiles para detectar el anión f¯ en disolución (Black et al., 1999). En 2020 se desarrolló un dispositivo portátil y económico para la detección colorimétrica y la estimación rápida de iones f¯ en el agua, mediante la adición de nanopartículas núcleo- envoltura, consistentes de nanocajas (ncs) ceria@zirconia (ceo2@zro2) recubiertas de etilenglicol, con alta afinidad hacia f¯, y el tinte naranja de xilenol, que cambia rápidamente de amarillo a rojo tras la interacción con f¯ (figura 2). El sensor es altamente selectivo hacia f¯ y muestra una sensibilidad sin precedentes en el intervalo 0.1-5.0 mg/l en muestras de agua de campo. Este sensor se ha probado con estándares sintéticos de f¯, muestras de agua reales, pastas dentales y enjuagues bucales, mediante el uso de un accesorio para teléfono inteligente y a simple vista (Mukherjee et al., 2020).
Otro dispositivo portátil fue desarrollado en 2021 con el objetivo de medir concentraciones de f¯ en agua basándose en la formación de un complejo fe-scn colorido. Se usa una disolución de fe(no3)3.9h2o en hclo4 y nh4scn soportada en un algodón comprimido, que al interaccionar con iones f¯ forma enlaces fe-f y genera una substancia incolora. Este dispositivo puede ser conectado al celular y los datos se pueden leer mediante una aplicación basada en la ley de Lambert-Beer, demás de que se puede determinar la ubicación y profundidad del pozo, en el intervalo de 0.7 a 8.0 mg/l (Otal et al., 2021).
Por otra parte, en 2022 se desarrollaron películas ultrafinas de octadecilamina (oda) y con ellas se recubrieron nanotubos de carbono de pared simple (swcnt) para generar nanotubos de carbono funcionalizados (oda-swcnt), a través del método Langmuir-Schaefer (ls). Para ello se utilizó una microbalanza electroquímica de cristal de cuarzo eqcm para la detección de f¯ en medio acuoso. El intervalo de concentración del ion f¯ detectable es de 0.5 a 145 mg/l. (Taneja et al., 2022). También en 2022 se sintetizó un sensor a base de cumarina, que puede reconocer el ion f¯ en acetonitrilo mediante un cambio de color detectable a simple vista de amarillo a rosa. La interacción del f¯ con el sensor se produce a través de puentes de hidrógeno (figura 3) (Maity et al., 2022).
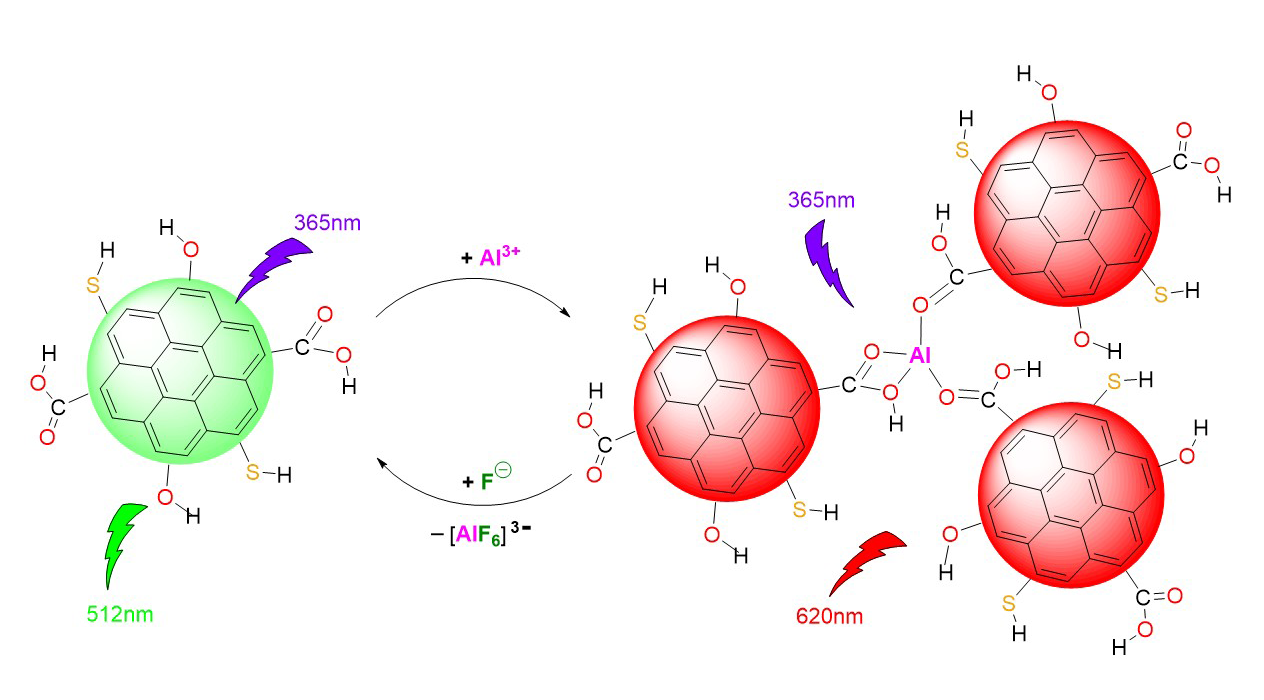
En 2023 se creó una plataforma para teléfono inteligente integrado con inteligencia artificial (ia), la cual se basa en tiras de prueba que contienen puntos de carbono (cds, por sus siglas en inglés) funcionalizados con iones al3+ (cds@al3+), los cuales exhiben una emisión verde moderada a 512 nm y roja débil a 620 nm bajo una excitación a 365 nm (figura 4), que es empleada para medir la concentración de f¯ por colorimetría en un intervalo de 0 a 0.0012 m (0-23 mg/l). Los cds se sintetizan a partir de carmín de alizarina y ácido cítrico, por lo que su superficie podría estar rodeada de grupos hidroxilo (oh), carboxilo (cooh) y sulfhidrilo (sh).
La emisión roja probablemente se origina por la agregación de cds que el al3+ (un ácido duro) provoca al coordinarse con los oxígenos (bases duras) de los grupos mencionados. La adición de f¯ (una base más dura que el oxígeno) a esta disolución de cds@al3+ provoca que los iones f¯ capturen a los iones al3+, formando [alf6]3¯ y destruyendo los agregados. Por lo tanto, a medida que aumenta la concentración de f¯ en la muestra, la emisión a 620 nm disminuye de forma notable, mientras que emerge el pico a 512 nm y el color va de rojo a verde. Así, el contenido de f¯ en agua de grifo y pasta de dientes fue analizado de manera inteligente, rápida y directa a través de esta plataforma de detección portátil, teniendo como fundamento químico el propuesto en la figura 5 (Yan et al., 2023).
Figura 4
Espectros de fluorescencia de la disolución de cds@al3+ con diferentes concentraciones de f¯ bajo excitación a 365 nm
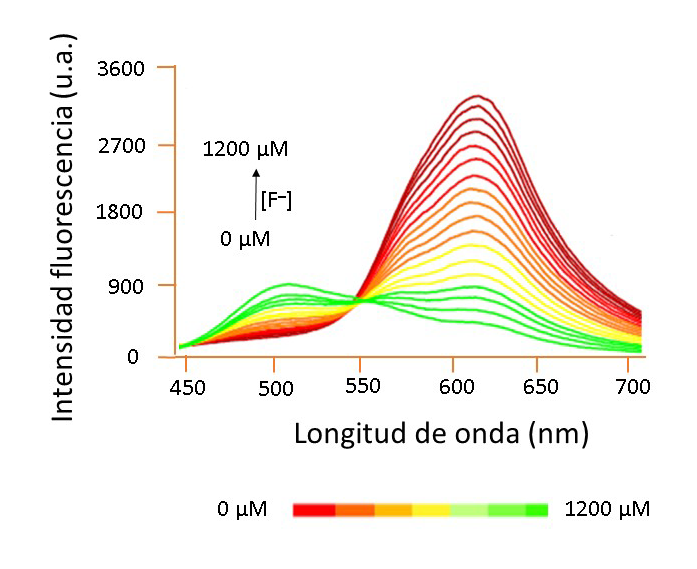
Fuente: elaboración propia.
Figura 5
Respuesta de cds a al3+ y subsecuente interacción con f¯
Fuente: elaboración propia.
Procesos de remoción de fluoruro
La remoción de un contaminante del agua es el proceso por el cual pasa el agua para eliminar el contaminante. Para la descontaminación de f¯ en el agua se han investigado varios procesos, como adsorción, nanofiltración, intercambio iónico, electrocoagulación y tecnologías basadas en membranas. Por su viabilidad económica mencionamos sólo algunos procesos de adsorción explorados de manera reciente.
La adsorción es un método versátil y ampliamente usado para la remoción de contaminantes en el agua y se define como un proceso en el cual un gas o un líquido se acumula en la superficie de un sólido o líquido (adsorbente), formando una película molecular o atómica (adsorbato) (Burciaga-Montemayor et al., 2020). Los nuevos materiales adsorbentes que se han estudiado como alternativa al carbón activado en la eliminación del f¯ de las aguas residuales son el negro de carbón grafitado, oxihidróxido de hierro (iii), nanoóxido bimetálico de hierro (iii) y titanio (iv), dióxido de titanio, óxido de magnesio, óxido cúprico, hidróxido de aluminio, resinas de intercambio iónico, adsorbentes compuestos y modificados (zeolitas, hidrotalcitas e hidroxiapatitas) (Rahdar et al., 2019).
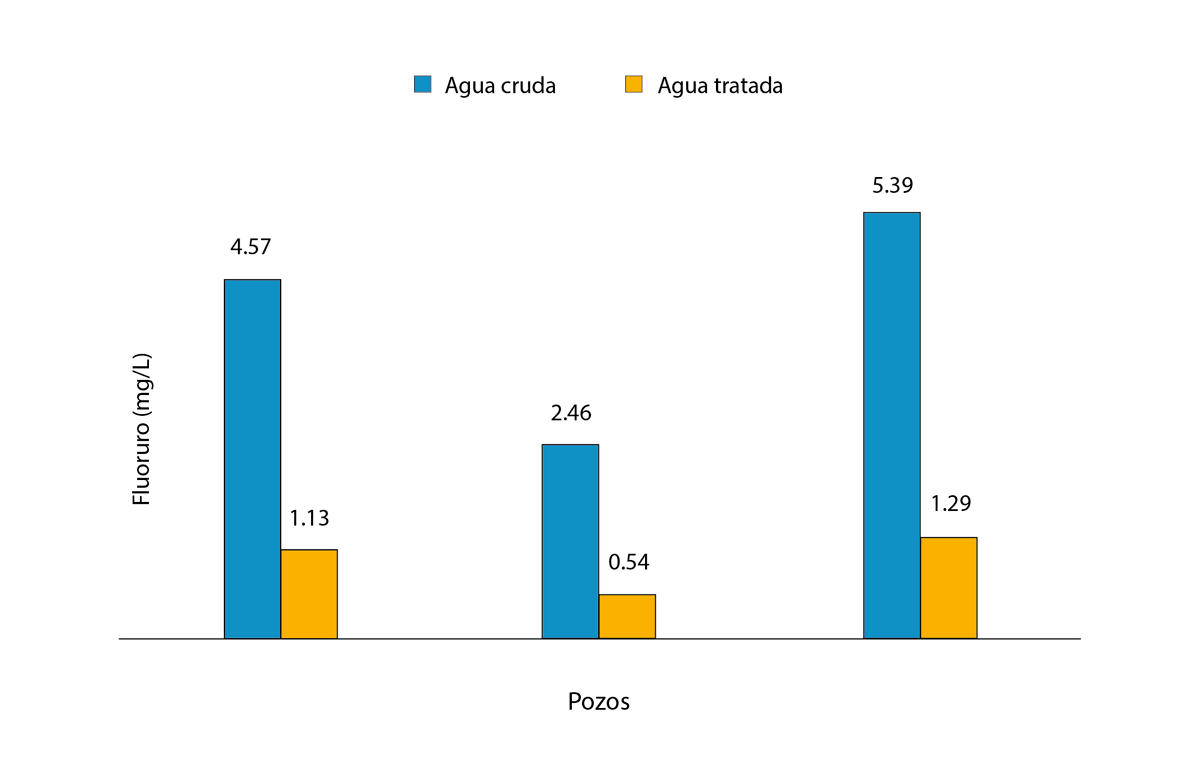
Destaca en 2023 el desarrollo de un material adsorbente para la desfluoración basado en sílice extraída de la roca pómez, a través de un proceso de lixiviación alcalina, seguido de la modificación de su superficie con iones de fe3+ para mejorar su afinidad por f¯. Se analizaron los efectos del ph, tiempo de contacto, cantidad de adsorbente y concentración inicial de f¯. Para la desfluoración de una disolución de f¯ de 20 mg/l, los valores óptimos fueron ph 6, 1 g de adsorbente y 45 minutos de contacto. La efectividad del adsorbente se evaluó utilizando muestras de agua provenientes de tres pozos, observando que los niveles de f¯ en el agua de los pozos disminuyeron drásticamente, como se observa en la figura 6 (Kiprono et al., 2023).
Los estudios de reutilización demostraron que el material absorbente puede reciclarse hasta cinco veces sin perder eficiencia significativa. Se concluyó que el adsorbente a base de sílice, desarrollado a partir de la roca de pómez de fácil obtención, es adecuado para eliminar el f¯ del agua.
Figura 6
Comparación de niveles de f¯ en aguas subterráneas crudas y tratadas con el material adsorbente modificado con fe3+
Fuente: elaboración propia.
Conclusiones
La presencia de f¯ en el agua, proveniente tanto de fuentes naturales como antropogénicas, representa un riesgo creciente para la salud pública, debido a la sobreexplotación de acuíferos y perforación de pozos profundos. La exposición prolongada a altas concentraciones de f¯ puede tener efectos adversos en la salud, como deterioro del metabolismo de la glucosa, fluorosis dental o esquelética y, en casos extremos, la muerte. Este problema podría convertirse en un problema nacional grave, especialmente al consumir alimentos cocinados con agua que contiene una alta concentración de este ion.
La regulación de los niveles de f¯ en el agua potable y la implementación de estrategias para disminuir su concentración cuando excede los límites permitidos son pasos cruciales para mitigar los efectos adversos en la salud. Se deben seguir las instrucciones de uso de productos dentales y minimizar las descargas de las industrias que contengan f¯ en sus aguas residuales.
Aunque existen tecnologías prometedoras para la detección y eliminación del f¯ en el agua, su implementación a gran escala aún enfrenta desafíos relacionados con la viabilidad económica y la sostenibilidad ambiental. Es imperativo determinar los niveles seguros de consumo en la población y continuar la investigación y el desarrollo de soluciones efectivas y accesibles para el tratamiento del f¯ en el agua, con el fin de proteger la salud pública y prevenir una futura crisis sanitaria.
Referencias
Alarcón-Herrera, M. T., Bundschuh, J., Nath, B., Nicolli, H. B., Gutiérrez, M., Reyes-Gómez, V. M., Núñez, D., Martín-Domínguez, I. R. y Sracek, O. (2013). Co-occurrence of arsenic and fluoride in groundwater of semi-arid regions in Latin America: Genesis, mobility and remediation. Journal of Hazardous Materials, 262, 960-969. https://doi.org/10.1016/j.jhazmat.2012.08.005
Alarcón-Herrera, M. T., Martin-Alarcón, D. A., Gutiérrez, M., Reynoso-Cuevas, L., Martín-Domínguez, A., Olmos-Márquez, M. A. y Bundschuh, J. (2020). Co-occurrence, possible origin, and health-risk assessment of arsenic and fluoride in drinking water sources in Mexico: geographical data visualization. Science of the Total Environment, 698, 1-8. https://doi.org/10.1016/j.scitotenv.2019.134168
Apambire, W. B., Boyle, D. R. y Michel, F. A. (1997). Geochemistry, genesis, and health implications of fluoriferous groundwaters in the upper regions of Ghana. Environmental Geology, 33(1), 13-24. https://doi.org/10.1007/s002540050221
Black, C. B., Andrioletti, B., Try, A. C., Ruipérez, C. y Sessler, J. L. (1999). Dipyrrolylquinoxalines: efficient sensors for fluoride in organic solution. Journal of the American Chemical Society, 121(44), 10438-10439. https://doi.org/10.1021/ja992579a
Burciaga-Montemayor, N. G., Claudio-Rizo, J. A., Cano-Salazar, L. F., Martínez-Luévanos, A. y Vega-Sánchez, P. (2020). Compósitos en estado hidrogel con aplicación en la adsorción de metales pesados presentes en aguas residuales. tip. Revista Especializada en Ciencias Químico-Biológicas, 23. https://doi.org/10.22201/fesz.23958723e.2020.0.211
Castañeda Villanueva, A. A. (2020). Increase in the concentration of fluorine compounds as indicator of the decrease in the dynamic level in groundwater in a population of western Mexico. Journal of Research in Environmental and Earth Sciences, 6(4), 55-65. https://www.questjournals.org/jrees/papers/vol6-issue4/G06045565.pdf
Chang, R. (2007). Chemistry. McGraw-Hill, 9a ed. https://archive.org/details/chemistry00raym/page/n1/mode/1up
Clark, M. B., Keels, M. A., Slayton, R. L., Braun, P. A., Fisher-Owens, S., Huff, Q. A., Karp, J. M., Rao Tate, A., Unkel, J. H. y Krol, D. (2020). Fluoride use in caries prevention in the primary care setting. Pediatrics, 146(6), 1-11. https://doi.org/10.1542/peds.2020-034637
Comisión Nacional del Agua (2022). Indicadores de la calidad del agua superficial y subterránea. Red Nacional de Medición de la Calidad del Agua (renameca). semarnat/conagua/renameca. https://files.conagua.gob.mx/Ica20/Contenido/Documentos/PresentaciondeIndicadoresdelaCalidaddelAgua.pdf
Committee on Fluoride in Drinking Water, Board on Environmental Studies and Toxicology y Division on Earth and Life Studies (2006). Fluoride in drinking water: a scientific review of epa’s standards. The National Academies Press. https://www.actionpa.org/fluoride/nrc/NRC-2006.pdf
Cruz Cardoso, D. de la, Castillo Chaires, I., Arteaga Mejía, M., Cervantes Sandoval, A. y Pinelo Bolaños, P. (2013). Analysis of the concentration of fluoride in bottled water in different Mexican states. Revista Asociación Dental Mexicana, 70(2), 81-90. https://www.medigraphic.com/pdfs/adm/od-2013/od132g.pdf
Dirección General de Desarrollo Minero (2021). Perfil de mercado de la fluorita. Secretaría de Economía. https://www.gob.mx/cms/uploads/attachment/file/624810/9Perfil_Fluorita_2020__T_.pdf
García-Montiel, E., Zepeda-Mondragón, F., Morones-Esquivel, M. M., Ramírez-Aldaba, H., López-Serrano, P. M., Briseño-Reyes, J. y Montiel-Antuna, E. (2023). Probabilistic risk assessment of exposure to fluoride in drinking water in Victoria de Durango, Mexico. Sustainability, 15(19). https://doi.org/10.3390/su151914630
Ghosh, D. y Ghosh, S. (2020). Flouride and brain: a review. International Journal of Pharmaceutical Sciences and Research, 11(5), 2011-2017. https://doi.org/10.13040/IJPSR.0975-8232.11(5).2011-17
González-Horta, C., Ballinas-Casarrubias, L., Sánchez-Ramírez, B., Ishida, M. C., Barrera- Hernández, A., Gutiérrez-Torres, D., Zacarias, O. L., Saunders, R. J., Drobná, Z., Mendez, M. A., García-Vargas, G., Loomis, D., Stýblo, M. y Razo, L. M. del (2015). A concurrent exposure to arsenic and fluoride from drinking water in Chihuahua, Mexico. International Journal of Environmental Research and Public Health, 12, 4587-4601. https://doi.org/10.3390/ijerph120504587
Gopu, B. P., Azevedo, L. B., Duckworth, R. M., Subramanian, M. K. P., John, S. y Zohoori, F. V. (2023). The relationship between fluoride exposure and cognitive outcomes from gestation to adulthood—a systematic review. International Journal of Environmental Research and Public Health, 20(1), 1-13. https://doi.org/10.3390/ijerph20010022
Gutiérrez, M., Espino Valdés, M. S., Alarcón-Herrera, M. T., Pinales-Munguía, A. y Silva-Hidalgo, H. (2021). Arsénico y flúor en agua subterránea de Chihuahua: su origen, enriquecimiento, y tratamientos posibles. Tecnociencia Chihuahua. Revista de Ciencia y Tecnología, 15(2), 1-14. https://doi.org/10.54167/tecnociencia.v15i2.828
Gutiérrez, M. y Alarcón-Herrera, M. T. (2022). Fluoruro en aguas subterráneas de la región centro-norte de México y su posible origen. Revista Internacional de Contaminación Ambiental, 38, 389-397. https://doi.org/10.20937/rica.54307
Hattab, F. N. (2020). An update on fluorides and fluorosis with reference to oral health status in the gulf region: review. Asian Journal of Dental Sciences, 3(1), 27-48. https://www.researchgate.net/publication/340581756
Hurtado, R. y Gardea-Torresdey, J. (2004). Environmental evaluation of fluoride in drinking water at “Los Altos de Jalisco,” in the Central Mexico Region. Journal of Toxicology and Environmental Health. Parte A, Temas Actuales, 67(20-22), 1741-1753. https://doi.org/10.1080/15287390490493448
Jaccaud, M., Faron, R., Devilliers, D. y Romano, R. (2000). Fluorine. Ullmann’s Encyclopedia of Industrial Chemistry ii Fluorine. Wiley. https://doi.org/10.1002/14356007.a11_293
Jarquín-Yáñez, L., Mejía-Saavedra, J. de J., Molina-Frechero, N., Gaona, E., Rocha-Amador, D. O., López-Guzmán, O. D. y Bologna-Molina, R. (2015). Association between urine fluoride and dental fluorosis as a toxicity factor in a rural community in the state of San Luis Potosi. The Scientific World Journal, 2015(1), 1-5. https://doi.org/10.1155/2015/647184
Javier Pérez, R., Rubio Armendáriz, C., Gutiérrez Fernández, Á. J., Paz Montelongo, S. y Hardisson, A. (2020). Niveles de fluoruro en dentífricos y colutorios. Journal of Negative and No Positive Results, 5(5), 491-503. https://doi.org/10.19230/jonnpr.3326
Jiménez Ángeles, M. de J., Ruiz-Ramos, R. y Loera-Serna, S. (2023). Nanomateriales y su aplicación en la retención de fluoruros en sistemas acuosos. Elementos, 129, 35-39. https://elementos.buap.mx/post.php?id=756
Kiprono, P., Kiptoo, J., Nyawade, E. y Ngumba, E. (2023). Iron functionalized silica particles as an ingenious sorbent for removal of fluoride from water. Scientific Reports, 13(1), 1-13. https://doi.org/10.1038/s41598-023-34357-8
Kumar, R., Ali, S., Sandanayake, S., Islam, M. A., Ijumulana, J., Maity, J. P., Vithanage, M., Armienta, M. A., Sharma, P., Hamisi, R., Kimambo, V. y Bhattacharya, P. (2024). Fluoride as a global groundwater contaminant. En R. Naidu (ed.), Inorganic Contaminants and Radionuclides (pp. 319-350). Elsevier. https://doi.org/10.1016/B978-0-323-90400-1.00010-0
Maity, S., Maity, A. C., Kumar Das, A., Roymahapatra, G., Goswami, S. y Mandal, T. K. (2022). Colorimetric and theoretical investigation of coumarin based chemosensor for selective detection of fluoride. Journal of Molecular Structure, 1264, 1-7. https://doi.org/10.1016/j.molstruc.2022.133228
Martínez-Prado, M. A., Pérez-López, M. E., Vicencio de la Rosa, M. G. y González-Nevarez, C. C. (2013). Concentration of Fluoride and Arsenic in Bottled Drinking Water in Durango City, Mexico. Journal of Environmental Protection, 4(12), 8-13. https://doi.org/10.4236/jep.2013.412a2002
Molina Frechero, N., Sánchez Pérez, L., Castañeda Castaneira, E., Oropeza Oropeza, A., Gaona, E., Salas Pacheco, J. y Bologna Molina, R. (2013). Drinking water fluoride levels for a city in northern Mexico (Durango) determined using a direct electrochemical method and their potential effects on oral health. The Scientific World Journal, 2013(1), 1-6. https://doi.org/10.1155/2013/186392
Morales-Arredondo, J. I., Armienta-Hernández, M. A., Lugo-Dorantes, A. E., Barrera-Arrazola, A. P., Flores-Ocampo, I. Z. y Flores-Vargas, R. (2022). Fluoride presence in drinking water along the southeastern part of El Bajío Guanajuatense, Guanajuato, Mexico: sources and health effects. Environmental Geochemistry and Health, 45(6), 3715-3742. https://doi.org/10.1007/s10653-022-01426-2
Morales de Ávila, H., Gutiérrez, M., Colmenero-Chacón, C. P., Júnez-Ferreira, H. E. y Esteller- Alberich, M. V. (2023). Upward trends and lithological and climatic controls of groundwater arsenic, fluoride, and nitrate in central Mexico. Minerals, 13(9), 1-12. https://doi.org/10.3390/min13091145
Morales-Simfors, N., Bundschuh, J., Herath, I., Inguaggiato, C., Caselli, A. T., Tapia, J., Choquehuayta, F. E. A., Armienta, M. A., Ormachea, M., Joseph, E. y López, D. L. (2020). Arsenic in Latin America: a critical overview on the geochemistry of arsenic originating from geothermal features and volcanic emissions for solving its environmental consequences. Science of the Total Environment, 716, 1-105. https://doi.org/10.1016/j.scitotenv.2019.135564
Mukherjee, S., Shah, M., Chaudhari, K., Jana, A., Sudhakar, C., Srikrishnarka, P., Islam, M. R., Philip, L. y Pradeep, T. (2020). Smartphone-based fluoride-specific sensor for rapid and affordable colorimetric detection and precise quantification at sub-ppm levels for field applications. acs Omega, 5(39), 25253-25263. https://doi.org/10.1021/acsomega.0c03465
Navarro, O., González, J., Júnez-Ferreira, H. E., Bautista, C. F. y Cardona, A. (2017). Correlation of Arsenic and Fluoride in the Groundwater for Human Consumption in a Semiarid Region of Mexico. Procedia Engineering, 186, 333-340. https://doi.org/10.1016/j.proeng.2017.03.259
Ortega-Guerrero, M. A. (2009). Presencia, distribución, hidrogeoquímica y origen de arsénico, fluoruro y otros elementos traza disueltos en agua subterránea, a escala de cuenca hidrológica tributaria de Lerma-Chapala, México. Revista Mexicana de Ciencias Geológicas, 26(1), 143-161. http://www.scielo.org.mx/scielo.php?script=sci_arttext&pid=S1026-87742009000100012&lng=es&tlng=
Ortiz Letechipia, J., González-Trinidad, J., Júnez-Ferreira, H. E., Bautista-Capetillo, C., Robles- Rovelo, C. O., Contreras Rodríguez, A. R. y Dávila-Hernández, S. (2022). Aqueous arsenic speciation with hydrogeochemical modeling and correlation with fluorine in groundwater in a semiarid region of Mexico. Water, 14(4), 1-16. https://doi.org/10.3390/w14040519
Otal, E. H., Kim, M. L., Dietrich, S., Takada, R., Nakaya, S. y Kimura, M. (2021). Open-source portable device for the determination of fluoride in drinking water. acs Sensors, 6(1), 259-266. https://doi.org/10.1021/acssensors.0c02273
Rahdar, A., Ahmadi, S., Fu, J. y Rahdar, S. (2019). Iron oxide nanoparticle preparation and its use for the removal of fluoride from aqueous solution: application of isotherm, kinetic, and thermodynamics. Desalination and Water Treatment, 137, 174-182. https://doi.org/10.5004/dwt.2019.23350
Rocha, R. A., Rojas, D., Clemente, M. J., Ruiz, A., Devesa, V. y Vélez, D. (2013). Quantification of fluoride in food by microwave acid digestion and fluoride ion-selective electrode. Journal of Agricultural and Food Chemistry, 61(45), 10708-10713. https://doi.org/10.1021/jf403728r
Sawangjang, B. y Takizawa, S. (2023). Re-evaluating fluoride intake from food and drinking water: effect of boiling and fluoride adsorption on food. Journal of Hazardous Materials, 443(parte A), 1-12. https://doi.org/10.1016/j.jhazmat.2022.130162
Scanlon, B. R., Stonestrom, D. A., Reedy, R. C., Leaney, F. W., Gates, J. y Cresswell, R. G. (2009). Inventories and mobilization of unsaturated zone sulfate, fluoride, and chloride related to land use change in semiarid regions, southwestern United States and Australia. Water Resources Research, 45(7), 1-17. https://doi.org/10.1029/2008WR006963
Skórka-Majewicz, M., Goschorska, M., Żwierełło, W., Baranowska-Bosiacka, I., Styburski, D., Kapczuk, P. y Gutowska, I. (2020). Effect of fluoride on endocrine tissues and their secretory functions – review. Chemosphere, 260, 1-13. https://doi.org/10.1016/j.chemosphere.2020.127565
Sosa-Soto, J., Padrón-Covarrubias, A. I., Márquez-Preciado, R., Ruiz-Rodríguez, S., Pozos- Guillén, A., Pedroza-Uribe, I. M., Bayardo-González, R. A. y Garrocho-Rangel, A. (2022). Molar incisor hypomineralization (mih): prevalence and degree of severity in a Mexican pediatric population living in an endemic fluorosis area. Journal of Public Health Dentistry, 82(1), 3-10. https://doi.org/10.1111/jphd.12446
Taneja, P., Manjuladevi, V., Gupta, R. K. y Gupta, K. K. (2022). Ultrathin film of octadecylamine functionalized single-walled carbon nanotubes for selective fluoride ion sensing in aqueous medium. Nano Express, 4(4), 1-10. https://doi.org/10.1088/2632-959X/ad0fa7
us Department of Health & Human Services, Public Health Service y Agency for Toxic Substances and Disease Registry (1993). Toxicological profile for fluorides, hydrogen fluoride, and fluorine. us Department of Health & Human Services/Public Health Service/ Agency for Toxic Substances and Disease Registry. https://books.google.com.mx/books?id=GU8Lj0_pWLsC&printsec=frontcover&hl=de&source=gbs_ge_summary_r&cad=0#v=onepage&q&f=false
Valdez-Jiménez, L., Valdez-Jiménez, L. M., Marín-Barba, P. y Pérez-Vega, M. I. (2023). Correlation analysis of fluoride levels and cognitive test performances in the adult population exposed to water consumption with high concentrations of fluoride. Fluoride, 56(1), 2-8. https:/www.fluorideresearch.online/epub/files/167.pdf
Vázquez-Bojórquez, C., López-Verdín, S., Villanueva-Arriaga, R., Castañeda-Castaneira, E., Juárez-López, M. L. A. y Molina-Frechero, N. (2022). Fluorides in water for consumption in northern and western Mexico. Revista Médica del Instituto Mexicano del Seguro Social, 60(2), 179-187. https://pubmed.ncbi.nlm.nih.gov/35759557/
Vélez-León, E., Rodas-Flores, M. J., González-Guzmán, M. A. y Cuenca-León, K. (2019). Análisis de la concentración de flúor en el agua de abastecimiento público del cantón Cuenca, como posible factor que contribuye al desarrollo de fluorosis dental. Analysis, 23(6), 1-9. https://doi.org/10.5281/zenodo.3910800
Vithanage, M. y Bhattacharya, P. (2015). Fluoride in the environment: sources, distribution and defluoridation. Environmental Chemistry Letters, 13(2), 131-147. https://doi.org/10.1007/s10311-015-0496-4
Wallace Walser iii, J. (2021). Hidden dangers? An investigation of volcanic and environmental impacts on human health and life in historical Iceland. [Tesis de doctorado, University of Iceland]. https://opinvisindi.is/bitstream/handle/20.500.11815/2516/Walser_PhD_v2.pdf?sequence=3&isAllowed=y
World Health Organization (2023). Guidelines for drinking-water quality: fourth edition incorporating the first and second addenda. who. https://www.who.int/publications/i/item/9789240045064
Yan, L., Zhang, B., Zong, Z., Zhou, W., Shuang, S. y Shi, L. (2023). Artificial intelligence-integrated smartphone-based handheld detection of fluoride ion by al3+-triggered aggregationinduced red-emssion enhanced carbon dots. Journal of Colloid and Interface Science, 651, 59-67. https://doi.org/10.1016/j.jcis.2023.07.125
Zhou, J., Sun, D. y Wei, W. (2023). Necessity to pay attention to the effects of low fluoride on human health: an overview of skeletal and non-skeletal damages in epidemiologic investigations and laboratory studies. Biological Trace Element Research, 201(4), 1627-1638. https://doi.org/10.1007/s12011-022-03302-7