Inventio
Vol. 20, núm. 51, 2024
doi: http://doi.org/inventio/10.30973/2024.20.51/3
Efecto de la fertilización orgánica y biológica en plántulas de papaya (Carica papaya L.)
Effect of organic and biological fertilization on papaya (Carica papaya L.) seedlings
Edwin Anndy Sánchez-Martínez
orcid: 0000-0003-1748-258X, 2anndy2@gmail.com
Programa de Maestría en Ciencias en Productividad en Agroecosistemas, Instituto Tecnológico del Valle de Oaxaca (itvo), Tecnológico Nacional de México (tecnm)
Ernesto Castañeda-Hidalgo
orcid: 0000-0001-9296-1439, casta_h50@hotmail.com
División de Estudios de Posgrado e Investigación, Instituto Tecnológico del Valle de Oaxaca (itvo), Tecnológico Nacional de México (tecnm)
Celerino Robles
orcid: 0000-0003-1291-729X, crobles_38@yahoo.it
Centro Interdisciplinario de Investigación para el Desarrollo Regional (ciidir), Unidad Oaxaca, Instituto Politécnico Nacional (ipn)
Gisela Margarita Santiago-Martínez
orcid: 0000-0002-0064-7010, gisela.sm@voaxac.tecnm.mx
División de Estudios de Posgrado e Investigación, Instituto Tecnológico del Valle de Oaxaca (itvo), Tecnológico Nacional de México (tecnm)
Salvador Lozano-Trejo
orcid: 0000-0001-6809-948X, salvador.lt@voaxaca.tecnm.mx
División de Estudios de Posgrado e Investigación, Instituto Tecnológico del Valle de Oaxaca (itvo), Tecnológico Nacional de México (tecnm)
resumen
El cultivo de Carica papaya L. demanda buscar nuevas formas de producción, optimizar la eficiencia de nutrición y reducir el uso de fertilizantes sintéticos. El objetivo fue evaluar la dinámica de crecimiento de plántulas de papaya cv. Maradol bajo el efecto de abonos orgánicos y biofertilizantes. Se evaluaron variables de crecimiento vegetal, microbiológicas e índices morfológicos. Los registros de las variables se realizaron al finalizar el ensayo. El diseño experimental fue aleatorio, con seis repeticiones por tratamiento. Se concluye que la combinación de la fertilización orgánica y biológica puede sustituir la fertilización química y representa una alternativa viable para la nutrición de las plántulas de papaya.
palabras clave
Carica papaya L., abonos orgánicos, biofertilizantes, microorganismos
abstract
The cultivation of Carica papaya L. demands the search for new forms of production, optimize the efficiency of nutrition and reduce the use of synthetic fertilizers. The objective was of evaluating the growth dynamics of papaya seedlings cv. Maradol under the effect of organic fertilizers and biofertilizers. Variables of plant growth, microbiological and morphological indices were evaluated. The variable recordings were made at the end of the trial. The experimental design was random with six repetitions per treatment. It is concluded that the combination of organic and biological fertilization can replace chemical fertilization and represents a viable alternative for the nutrition of papaya seedlings.
key words
Carica papaya L., organic fertilizers, biofertilizers, microorganisms
Recepción: 09/02/24. Aceptación: 30/05/24. Publicación: 13/11/24.
Introducción
El cultivo de la papaya ha experimentado un crecimiento en todo el mundo en los últimos años debido a la demanda de los consumidores por sus propiedades nutritivas, medicinales y por su sabor. Para los agricultores, éste es un cultivo que permite obtener ingresos a partir de los seis meses de trasplantado (García, 2010), y el dinamismo en su comercialización es de importancia económica en países como México, Brasil y Guatemala (Valencia Sandoval et al., 2017).
El control de plagas y enfermedades y la nutrición del cultivo de papaya se realiza a través de métodos químicos. Para el primero se utilizan generalmente productos etiquetados con banda roja y en concentraciones altas, de acuerdo con lo recomendado por la casa comercial respectiva, los cuales contaminan el ambiente y afectan la calidad de los productos y la salud de quienes los cosechan y consumen (Meneses Moreno, 2017).
El uso constante de las tierras para el cultivo de papaya bajo el modelo convencional en la costa de Oaxaca ha normalizado prácticas que inducen la baja fertilidad de los suelos y su desgaste por la extracción constante de nutrientes, lo que obliga a aplicar dosis altas de nutrientes químicos para evitar un déficit en la nutrición y una mala calidad en los frutos, así como al uso constante de agroquímicos para evitar la presencia de plagas y enfermedades (Food and Agriculture Organization of the United Nations [fao], 2013). Esta última práctica en suelos cultivados con manejo intensivo provoca un desbalance nutrimental, así como disminución de la actividad biológica y del contenido de materia orgánica (Ndiaye et al., 2000)..
La utilización de agroquímicos sintéticos en la agricultura ha causado la pérdida de la capa fértil de los suelos, ha disminuido su biodiversidad y ha eliminado de forma paulatina a los enemigos naturales de las plagas (Battacharyya et al., 2015). En la actualidad, es incuestionable la necesidad de reducir los efectos del cambio climático en la agricultura, lo que ha orientado el interés en el uso de bioproductos que ayudan a aumentar los rendimientos agrícolas, así como en el tratamiento y la prevención de enfermedades en las plantas (Crouch y Staden, 1993; Povero et al., 2016). La aplicación de productos orgánicos en el suelo es necesaria en la agricultura sustentable, ya que representa una fuente indispensable para suministrar nutrimentos y reconstruir la materia orgánica (Álvarez-Sánchez et al., 2006).
Otra opción son los biofertilizantes a base de microorganismos aplicados al suelo o las plantas para sustituir la fertilización sintética de manera parcial o total, así como reducir la contaminación por agroquímicos (Armenta-Bojórquez et al., 2010). La presente investigación se realizó con el objetivo de evaluar el crecimiento en plántulas de Carica papaya L. bajo el efecto de abonos orgánicos y biofertilizantes en condiciones semicontroladas.
Metodología
El experimento se desarrolló bajo condiciones de casa sombra sin control de temperatura, en las instalaciones del Instituto Tecnológico del Valle de Oaxaca, localizado en Nazareno, municipio de Santa Cruz Xoxocotlán, Oaxaca. Se emplearon plántulas de papaya cv. Maradol de 35 días de edad, germinadas en cepellones y con 20 cm de altura, las cuales se adquirieron de un vivero comercial. Se aclimataron y posteriormente se trasplantaron en bolsas de polietileno para invernadero, perforadas en la base con una dimensión de 40x40 cm. Cada maceta contuvo 3 kg de sustrato elaborado a base de una mezcla de yocuela (50%), arena (30%) y peat moss (20%). El sustrato se irrigó 24 h antes del trasplante con agua corriente.
El experimento se estableció bajo un diseño completamente aleatorizado, con seis repeticiones por tratamiento, donde cada plántula representó una repetición. La unidad experimental consistió en una maceta con una plántula.
Los dieciséis tratamientos evaluados se muestran a continuación, incluyendo las dosis a aplicar por cada unidad experimental. Se evaluaron tres testigos: T1: Testigo cero (tc) (sin aplicación); T2: Testigo orgánico (to), donde se utilizó el fertilizante comercial Desintox Plant (complejo de abonos orgánicos que contiene macro y micronutrientes y biofertilizantes a base de bacterias, enzimas y levadura, con una concentración de 20% de N, 14% de P, 59.5% de K, 35.4% de Ca, 997 ppm de Mg, 899 de Na, 61.69 de Fe, 3.46 de Zn, 0.44 de Cu y 8.05 de Mn), el cual fue aplicado de manera foliar en dosis de 150 ml L-1 de agua, cada quince días, una semana después del trasplante; T3: Testigo mineral (tm), donde se utilizó el fertilizante mineral comercial Yara Mila, complejo que contiene 21% de N-Total, 17% de P2O5, 3% de K2O, 0.4% de MgO, 4% de SO4 y 0.15% de Zn, en la dosis recomendada por el proveedor, la cual consistente en aplicaciones de 20 g de fertilizante mineral por unidad experimental cada quince días, con inicio a los siete días después del trasplante.
Los tratamientos con abonos orgánicos fueron cuatro: T4: Lombricomposta (lc); T5: Estiércol de vaca (ev); T6: Natur-abono® (Na), y T7: Guano de murciélago (Gm) (Guanobras). Los tratamientos con biofertilizantes fueron cinco: T8: Azotobacter sp. (Az) 2.3x106 bacterias ml-1; T9: Azospirillum brasilense (Ab) 5x106 g/dosis; T10: Glomus cubense (Gc) (10 g L), con una cuenta de veinte esporas por g de suelo; T11: Trichoderma harzianum (Th) 1.2x108 esporas por g/l/ dosis, y T12: Bactiva® (Ba) 1x108 g/dosis. Y los tratamientos en combinación de abonos orgánicos y biofertilizantes fueron los tratamientos T13 a T16: T13: Lc+Az+Ab+Gc+Th+Ba (C1); T14: Ev+Az+Ab+Gc+Th+Ba (C2); T15: Na+Az+Ab+Gc+Th+Ba (C3), y T16: Gm+Az+Ab+Gc+Th+Ba (C4). Los productos comerciales utilizados están certificados como productos orgánicos por la sagarpa (Registro crob-20-077-2010-001) y la agencia certificadora certimex (producto orgánico cmx-276-2006-48-48-48). Fueron adquiridos en el Centro Estatal de Fertilizantes Orgánicos de Oaxaca (cefo).
Respecto a la aplicación de los tratamientos, dosis y época de aplicación de la fertilización biológica, orgánica foliar y mineral al suelo, fue la siguiente: para los tratamientos de fertilización biológica mediante el uso de biofertilizantes, consistió en una dosis por unidad experimental aplicada cada quince días, una semana después del trasplante (tabla 1).
Los tratamientos orgánicos estiércol seco de vaca y lombricomposta se realizaron de acuerdo con las recomendaciones del proveedor: 2.0 kg/planta para cada uno de ellos. Para el guano de murciélago (Guanobras) y el fertilizante orgánico comercial Natur-abono®, se utilizaron las recomendaciones de los proveedores: una dosis de 10 ml L-1 de agua/planta cada quince días y una dosis de 2.0 kg/planta, respectivamente. Todos los productos son comercializados por el cefo. La lombricomposta y el estiércol de vaca son producidos por el mismo cefo, con las concentraciones químicas que se indican en la tabla 2.
Respecto a la fertilización orgánica foliar, el Desintox Plant se asperjó en el follaje de acuerdo con la recomendación del proveedor: aplicaciones de 150 ml L-1 de agua, a intervalos de quince días, una semana después del trasplante. La composición del producto que se utilizó es de 20% de N-Total, 14% de P2O5, 59.5% de K2O.
La fertilización química mineral se aplicó únicamente en el testigo mineral, donde se utilizó el producto comercial Yara Mila en la dosis recomendada por el proveedor: aplicaciones de 20 g de fertilizante mineral por unidad experimental cada quince días, con inicio siete días después del trasplante. La composición de este producto es de 21% de N-Total, 17% de P2O5, 3% de K2O, 0.4% de MgO, 4% de SO4 y 0.15% de Zn.
El suministro de riego se realizó con agua potable, tres veces por semana, a razón de 500 ml por aplicación. La eliminación de las hojas inferiores, brotes laterales y malezas se realizó de forma manual. No se presentaron problema de plagas y enfermedades; sin embargo, para la prevención del ataque por ácaros se realizaron aspersiones de aceite de neem cada treinta días, después del trasplante a las plantas y bolsas, a razón de 3 ml L-1 de agua, y para los nematodos, se utilizó un producto a base de Bacillus subtilis. Para la prevención de enfermedades se aplicó un extracto de Reynoutria sachalinensis (5 ml L-1 de agua) como fungicida orgánico. Para la prevención de plagas se aplicó un insecticida orgánico elaborado a base de chile, ajo y canela (3 ml L-1 de agua) + fenilo propenal (3 ml L-1 de agua).
Tabla 1
Aplicación y dosis de biofertilizantes empleados en el estudio de plantúlas de papaya
| Producto | Aplicación | Dosis |
|---|---|---|
| Azotobacter sp. | 2.3x106 bacterias ml-1 | 4 ml L-1 de agua |
| Azospirillum brasilense | 5x106 g/dosis | 4 g L-1 de agua |
| Glomus cubense | 20 esporas g/suelo | 10 g L-1 de agua |
| Trichoderma harzianum | 1.2x108 esporas por g/l/dosis | 4 g L-1 de agua |
| Bactiva® | 1x108 g/dosis | 4 g L-1 de agua |
Fuente: elaboración propia.
Tabla 2
Características nutricionales de los abonos orgánicos empleados en el estudio
| Lombricomposta (%) | Natur-abono® (%) | Guano de murciélago (%) | Estiércol de vaca (%) | |
|---|---|---|---|---|
| N | 2.2 | 0.2 | 0.0156 | 1.7 |
| P | 2.33 | 0.23 | 0.01382 | 0.3535 |
| K | 0.62 | 0.42 | 0.1173 | 2.1 |
Fuente: elaboración propia.
Variables de respuesta
Todos los registros de las variables se realizaron al finalizar el ensayo, 120 días después de la primera aplicación de los tratamientos. Las variables de crecimiento vegetal fueron: número de hojas (nh), altura de la planta (ap, cm), diámetro del tallo (dt, mm) y longitud radical principal (lr, cm). Para el cálculo de la biomasa seca total (bm, g), de cada muestra se separaron las partes de la biomasa aérea: tallo y hojas; para la biomasa radical, el suelo fue removido por completo de la muestra y se extrajeron de forma cuidadosa las raíces finas y las gruesas. Las dos partes se pesaron en fresco y posteriormente se secaron a 70 ºC, por tres días, hasta obtener un peso constante, en una estufa de secado marca Memmert, modelo 100-800.
En cuanto a las variables microbiológicas, se consideró el índice relativo de dependencia microbiológica (irdm, %) para las variables bm:

Asimismo, se consideró el porcentaje de colonización en la rizosfera de papaya (pcr, %) y el porcentaje de incremento de plántulas infectadas con microorganismos (pipi, %) con respecto a las plántulas sin infectar, con la variable ap:

Con respecto a los índices morfológicos, se consideró el índice de relación peso de la parte aérea/peso de la parte radical (itr), calculado a partir de la fórmula siguiente:
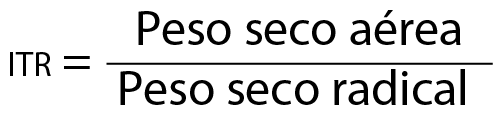
el índice de esbeltez (ie):

la relación altura de la plántula/longitud de la raíz (ialr):

y el índice de calidad de Dickson (icd):
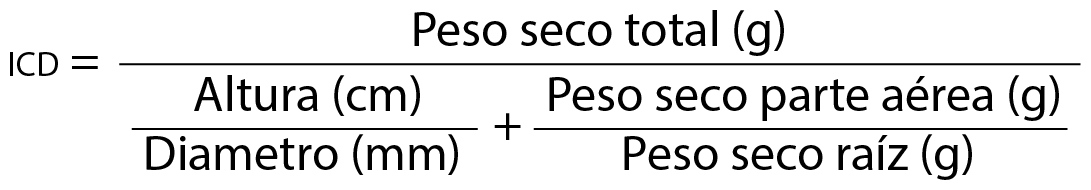
Los análisis estadísticos se elaboraron en el programa Statistical Analysis Software (sas), donde se realizó una estandarización de todas las variables por la fórmula de puntuación z (Helms et al., 1997):
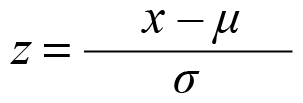
donde:
x= representa la cifra que quieres examinar,
μ= media,
σ= media,
Los datos de las variables medidas se sometieron a la prueba de homogeneidad de varianza de Bartlett, a los supuestos de normalidad de errores con base en la prueba de Shapiro-Wilk (p≤0.05) y a la prueba de comparación de medias Tukey (p≤0.05) (Montgomery, 2005). A las variables que no cumplieron estos criterios se les aplicó, para las variables nh, ap, dt, itr, ie e icd, una transformación de raíz cuadrada (x = √n + 1), y para las variables porcentuales irdm, pcr y pipi, la transformación de raíz cuadrada de ArcoSeno (Herrera y García, 2019), las cuales se ajustaron más para normalizar sus datos y estabilizar su varianza.
Resultados
Los análisis estadísticos demuestran que los efectos de fertilización orgánica fueron estadísticamente significativos (p<0.05) para todas las variables estudiadas en plántulas de papaya, con excepción de la variable itr. Se muestra que, en las variables, los valores máximos y mínimos y el coeficiente de variación de las muestras evaluadas fueron bajos, con excepción de la variable pipi, que presentó una alta variabilidad (36.86%) (tabla 3).
Variables de crecimiento vegetal
Respecto a las variables de crecimiento vegetal, Az fue el tratamiento que promovió el mayor crecimiento de ap. En la variable dt, el mejor tratamiento fue tm, seguido de C2, ya que, al estar combinados los abonos orgánicos y biofertilizantes, se obtienen mejores resultados en las plántulas y éstos son similares a los obtenidos con el tratamiento de fertilización química tradicional. Para la variable bm, los tratamientos con mejores resultados fueron tm, con 9.1 g, seguido de Az, con 7.9 g. Para las variables nh y lr, el tratamiento más representativo fue C1, con 11.7 hojas y 38.7 cm en promedio, respectivamente (tabla 4).
Variables microbiológicas
Para las variables microbiológicas, Az fue el tratamiento más representativo, con un irdm de 82.6% y un pipi de 33.8%. En el caso del pcr, el mejor tratamiento fue C2 (tabla 5). También se encontraron datos más elevados para plantas inoculadas con hongos micorrízicos arbusculares (hma).
Índices morfológicos
Para la variable itr, el mejor tratamiento fue Ab. En la variable ie, el tratamiento con el registro más alto fue tc, seguido de lc y tm. Para el caso de ialr, el mejor tratamiento fue C2. Para la variable ialr lo fue C2 y, en cuanto a la variable icd, los mejores resultados los tuvo C4 (tabla 6).
Tabla 3
Resumen del análisis de varianza del experimento, 120 días después de la primera aplicación de los tratamientos
| Variable | glError | √cme | cv (%) |
|---|---|---|---|
| nh | 80 | 0.2** | 6.01 |
| ap | 80 | 0.32** | 5.97 |
| dt | 80 | 0.22** | 5.77 |
| lr | 32 | 4.38** | 16.79 |
| bms | 32 | 0.97** | 19.4 |
| itr | 32 | 0.2ns | 11 |
| ie | 32 | 0.04** | 2.54 |
| ialr | 32 | 0.2** | 18.21 |
| icd | 32 | 0.48** | 13.21 |
| irdm | 32 | 0.04** | 6.88 |
| pcr | 32 | 0.05** | 14.5 |
| pipi | 32 | 0.07** | 36.86 |
nh=Número de hojas, ap=Altura de planta (cm), dt=Diámetro de tallo (mm), lr=Longitud radical principal (cm), bms=Biomasa seca total (g), irdm=Índice relativo de dependencia microbiológica (%), pcr=Porcentaje de colonización en la rizosfera de papaya (%), pipi=Porcentaje de incremento de plantas infectadas con microorganismos (%), itr=Índice de relación peso aéreo/peso radical, ie=Índice de esbeltez, ialr=Relación altura de la plántula/longitud de la raíz, icd=Índice de calidad de Dickson. glError=Grados de libertad del error, √cme=Raíz de cuadrado medio del error, cv=Coeficiente de variación, **=Altamente significativo (p<0.01), ns=No significativo (p efecto >0.05).
Fuente: elaboración propia.
Tabla 4
Efectividad de los tratamientos en las variables de crecimiento vegetal en plántulas de papaya, 120 días después de la primera aplicación
| Trat | nh | ap | dt | lr | bm |
|---|---|---|---|---|---|
| tc | 8.2±0.4 d* | 17.2±0.87 d | 7.5±0.52 b | 19±1.73 b | 1.4±0.2 g |
| to | 9.3±0.42 abcd | 25.2±1.64 bc | 12.7±0.58 a | 19.3±2.03 b | 3.9±0.17 defg |
| tm | 9±0.63 bcd | 30.3±2.22 ab | 15.4±0.78 a | 23.3±2.91 b | 9.1±0.95 a |
| lc | 9.5±0.56 abcd | 29±2.16 ab | 13±0.94 a | 26±3.06 ab | 4.3±1.16 cdef |
| ev | 9±0.37 bcd | 30.3±1 ab | 13.5±0.84 a | 27.7±2.6 ab | 3.5±0.19 efg |
| Na | 9.5±0.22 abcd | 30.3±0.57 ab | 15.2±0.54 a | 30.2±3.24 ab | 3.8±0.17 defg |
| Gm | 9.8±0.31 abcd | 21.9±0.69 cd | 13.7±1.04 a | 26.7±4.26 ab | 7±0.85 abc |
| Az | 10±0.52 abcd | 32.7±0.61 a | 15±0.38 a | 27±1.73 ab | 7.9±0.83 ab |
| Ab | 11.5±0.34 ab | 28.2±0.6 abc | 13.2±0.6 a | 28±3.46 ab | 6.4±0.78 abcde |
| Gc | 8.7±0.21 cd | 26.2±0.98 abc | 12.6±0.62 a | 30±2.89 ab | 5.3±0.07 bcdef |
| Th | 11±0.37 abc | 30.2±1.68 ab | 14.8±0.74 a | 20.3±2.33 b | 6.6±0.12 abcd |
| Ba | 10.2±0.75 abcd | 26.1±1.23 abc | 13.4±0.21 a | 24.7±1.86 b | 4.7±0.29 cdef |
| C1 | 11.7±0.76 a | 27.9±0.45 abc | 15±0.78 a | 38.7±0.88 a | 5.6±0.24 bcdef |
| C2 | 10±0.97 abcd | 31±2.54 ab | 15.3±0.76 a | 21±1.53 b | 3.3±0.15 fg |
| C3 | 8.5±0.34 cd | 27.9±1.27 abc | 13.9±0.47 a | 29±2.31 ab | 3.5±0.61 fg |
| C4 | 9.2±0.6 abcd | 25.5±0.81 bc | 13.3±0.56 a | 26.7±1.2 ab | 3.9±0.09 defg |
nh=Número de hojas, ap=Altura de planta (cm), dt=Diámetro de tallo (mm), lr=Longitud radical principal (cm), bm=Biomasa seca total (g), tc=Testigo cero, to=Testigo orgánico, tm=Testigo mineral, lc=Lombricomposta, ev=Estiércol de vaca, Na=Natur-abono®, Gm=Guano de murciélago, Az=Azotobacter sp., Ab=Azospirillum brasilense, Gc=Glomus cubense, Th=Trichoderma harzianum, Ba=Bactiva®, C1=Lombricomposta+combinado de biofertilizantes, C2=Estiércol+combinado de biofertilizantes, C3=Natur-abono®+combinado de biofertilizantes, C4=Guano+combinado de biofertilizantes. *=Medias con literales iguales no son estadísticamente diferentes, según la prueba de Tukey (p≤0.05). En la media se incluye ± error estándar.
Fuente: elaboración propia.
Tabla 5
Efectividad de los tratamientos en las variables microbiológicas de plántulas de papaya, 120 días después de la primera aplicación de los tratamientos
| Trat | irdm | pcr | pipi |
|---|---|---|---|
| Az | 82.6±1.86 a* | 33.8±3.47 a | 33.8±2.34 a |
| Ab | 78.3±2.63 a | 29.3±3.34 a | 9.5±0 cde |
| Gc | 74.5±0.35 ab | 34.2±2.91 a | 9.5±4.69 cde |
| Th | 79.7±0.38 a | 32.5±1.77 a | 14.5±5.27 bc |
| Ba | 71.4±1.73 ab | 33.3±4.68 a | 11.5±1.17 cde |
| C1 | 75.5±1.11 ab | 29.3±3.53 a | 12.8±0.67 cd |
| C2 | 58.4±1.65 c | 39.5±3.47 a | 25.7±4.68 ab |
| C3 | 58.7±7.57 c | 32.4±2.35 a | 6.1±3.74 cde |
| C4 | 65.4±0.8 bc | 27.1±5.12 a | 1.4±0 de |
Az=Azotobacter sp., Ab=Azospirillum brasilense, Gc=Glomus cubense, Th=Trichoderma harzianum, Ba=Bactiva®, C1=Lombricomposta+combinado de biofertilizantes, C2=Estiércol+combinado de biofertilizantes, C3=Natur-abono®+combinado de biofertilizantes, C4=Guano+combinado de biofertilizantes. *=Medias con literales iguales no son estadísticamente diferentes, según la prueba de Tukey (p≤0.05). En la media se incluye ± error estándar.
Fuente: elaboración propia.
Tabla 6
Efectividad de los tratamientos en las variables de los índices morfológicos de plántulas de papaya, 120 días después de la primera aplicación de los tratamientos
| Trat | itr | ie | ialr | icd |
|---|---|---|---|---|
| tc | 3.1 ± 0.58 a* | 2.9 ± 0.15 a | 1 ± 0.07 abc | 1.6 ± 0.15 e |
| to | 2 ± 0.22 a | 2.1 ± 0.09 b | 1.4 ± 0.15 ab | 13.9 ± 1.03 abcd |
| tm | 2.3 ± 0.17 a | 2 ± 0.09 b | 1.3 ± 0.09 abc | 7.8 ± 0.96 de |
| lc | 3.1 ± 0.1 a | 2.3 ± 0.2 b | 1.2 ± 0.14 abc | 8.2 ± 1.99 cde |
| ev | 2.3 ± 0.52 a | 2.2 ± 0.09 b | 1.1 ± 0.12 abc | 11.5 ± 2.19 bcde |
| Na | 1.9 ± 0.09 a | 1.9 ± 0.03 bc | 1 ± 0.11 abc | 10.4 ± 0.19 bcde |
| Gm | 1.6 ± 0.01 a | 1.5 ± 0.09 c | 0.8 ± 0.14 bc | 22.5 ± 0.16 ab |
| Az | 2.1 ± 0.17 a | 2.1 ± 0.06 b | 1.2 ± 0.06 abc | 16.6 ± 0.84 abcd |
| Ab | 4.1 ± 1.79 a | 1.9 ± 0.09 bc | 1 ± 0.13 abc | 10.7 ± 2.65 bcde |
| Gc | 2 ± 0.17 a | 2 ± 0.09 b | 0.9 ± 0.13 abc | 12.4 ± 0.71 bcde |
| Th | 1.7 ± 0.15 a | 2.3 ± 0.09 b | 1.4 ± 0.21 ab | 20.1 ± 2.66 abc |
| Ba | 2.8 ± 0.18 a | 2.1 ± 0.03 b | 1.1 ± 0.08 abc | 9 ± 0.39 cde |
| C1 | 2.6 ± 0.19 a | 1.9 ± 0.03 bc | 0.7 ± 0.03 c | 12.8 ± 0.58 bcde |
| C2 | 2.3 ± 0.2 a | 2.1 ± 0.06 b | 1.5 ± 0.15 a | 10.9 ± 0.29 bcde |
| C3 | 1.8 ± 0.15 a | 1.9 ± 0.03 bc | 0.9 ± 0.09 abc | 9.4 ± 0.72 cde |
| C4 | 2.6 ± 0.3 a | 2 ± 0.09 b | 1 ± 0.03 abc | 25.6 ± 7.81 a |
itr=Índice de relación peso aéreo/peso radical, ie=Índice de esbeltez, ialr=Relación altura de la plántula/longitud de la raíz, icd=Índice de calidad de Dickson. tc=Testigo cero, to=Testigo orgánico, tm=Testigo mineral, lc=Lombricomposta, ev=Estiércol de vaca, Na=Natur-abono®, Gm=Guano de murciélago, Az=Azotobacter sp., Ab=Azospirillum brasilense, Gc=Glomus cubense, Th=Trichoderma harzianum, Ba=Bactiva®, C1=Lombricomposta+combinado de biofertilizantes, C2=Estiércol+combinado de biofertilizantes, C3=Natur-abono®+combinado de biofertilizantes, C4=Guano+combinado de biofertilizantes. *=Medias con literales iguales no son estadísticamente diferentes, según la prueba de Tukey (p≤0.05). En la media se incluye ± error estándar.
Fuente: elaboración propia.
Discusión
En los resultados para este estudio se cumple con lo indicado por Montoya Oliver y Cámara Obregón (1996), quienes mencionan que generalmente se requiere que, al momento de obtener los pesos secos, el peso de la parte aérea no llegue a doblar la raíz. Birchler et al. (1998) mencionan que el itr es el balance que se presenta entre la parte transpirante y la parte absorbente, y se estima normalmente a partir de la relación de los pesos secos de cada una de las partes. De acuerdo con Reyes (2004), cuando se presentan valores del coeficiente de variación superiores al 20%, se considera que el carácter en estudio es muy variable.
Variables de crecimiento vegetal
Respecto a las variables de crecimiento vegetal, Azotobacter ha sido reportado como promotor de crecimiento vegetal. Aly et al. (2012) encontraron un crecimiento significativo en la altura de plantas de trigo. Sánchez López y Pérez Pazos (2018) también reportaron el gran potencial que tiene Azotobacter sp., ya que facilita el enraizamiento y el crecimiento de las plantas, lo que da buenos resultados en las plántulas. Esta bacteria usa los exudados de las raíces y suministra nitrógeno compuesto a las plantas, el cual secreta durante la fijación de nitrógeno atmosférico (Monib et al., 1979); además, éstos le proporcionan al microorganismo una fuente de energía y su actividad asociativa se ve reflejada en la planta en el vigor y en el aumento apreciable en la ganancia de nitrógeno.
En cuanto a la variable dt, Alcántara Jiménez et al. (2019) mencionan que la papaya cv. Maradol alcanzó su mayor altura con la fertilización biológica al igual que con la orgánica; en contraste, en la variable de grosor del tallo se obtuvo el mayor valor con la fertilización química.
Para la variable bm, Quiñones-Aguilar et al. (2014) reportan que el incremento en el crecimiento de plantas de papaya inoculadas con hongos micorrízicos arbusculares (hma) fue altamente significativo, a diferencia del presente estudio, en el que se obtuvo una mejor respuesta en bm por parte de Az. Por otro lado, Nava-Gutiérrez et al. (2012) mencionan que en la biomasa seca entre plantas de papaya cv. Maradol, con y sin aplicación de G. intraradices, no se obtuvieron diferencias.
La variedad de respuesta que tiene la papaya hacia la capacidad de acumular materia seca es el resultado de la asociación que tiene la plántula con el microorganismo, y depende de la variedad, la especie vegetal y la especie de microorganismo (Quiñones-Aguilar et al., 2014).
Cano y Cetina (2004) mencionan que, entre más largos sean los sistemas radicales, será mejor la absorción de nutrientes y de agua, por lo que van a propiciar una mejor tolerancia al estrés hídrico cuando sean trasplantadas a campo. Milanés Figueredo et al. (2005) mencionan que la materia orgánica del humus de lombriz es estable y se encuentra parcialmente humificada. Ambas características le confieren una gran capacidad de absorción, y la combinación de abonos orgánicos y biofertilizantes genera crecimiento en las plantas.
Estos resultados son similares a lo reportado por Román et al. (2013), quienes mencionan que, entre más materia orgánica se aplique, mayor será la cantidad microbiana, ya que al emplear abonos orgánicos en el suelo se continúa con el proceso de descomposición, por lo que se tendrá una mayor posibilidad de liberación de nutrientes.
Variables microbiológicas
Armenta-Bojórquez et al. (2010) señalan que, para la elaboración de biofertilizantes, el uso de cepas nativas de microorganismos muestra mayores posibilidades de efectividad en el campo, por ser éstos adecuados a las condiciones del suelo de cada región en México. En este rubro se han tenido resultados diferentes a los del presente estudio, como los reportados por Quiñones-Aguilar et al. (2014), cuyos registros estuvieron alrededor del 99% en plantas de papaya asociadas a hma, por lo que sugieren una necesidad de asociación muy fuerte entre ambos, lo que se ve manifestado en el crecimiento significativamente mayor en las plantas inoculadas, en contraste con las que no lo están.
Muñoz-Márquez et al. (2009) registraron valores que oscilan entre 13% y 32% durante el muestreo de seis meses. Por su parte, Quiñones-Aguilar et al. (2019) reportaron que los mejores porcentajes de incremento se obtuvieron de inóculos de hma en las plantas de papaya, por lo que éstos son más eficientes como promotores del crecimiento; además, algunos de ellos promovieron una mejor acumulación de biomasa seca, y otros, una altura.
Índices morfológicos
Respecto a la variable itr, Rodríguez Trejo (2008) afirma que la obtención de biomasa es relevante, ya que ahí se refleja el desarrollo de las plántulas en vivero. Los resultados muestran que existe una desproporción entre ambas secciones (parte aérea y sistema radical), aunque esto no puede ser relevante debido a que las plántulas presentan un buen sistema radical para proveer de energía a la parte aérea.
Para la variable ie, Sáenz et al. (2014) mencionan que la característica de calidad más importante de las plántulas es el diámetro, ya que facilita la predicción de la supervivencia de la plántula en campo y concreta la robustez del tallo, por lo que es asociado con el vigor y la supervivencia de la plantación.
Para la variable ialr, Prieto Ruiz et al. (1999) consideran que este indicador muestra cuál será el éxito de la plantación, para lo cual tiene que haber equilibrio y mesura entre la parte aérea y el sistema radical de las plántulas; en caso contrario, se podrían tener tasas bajas de supervivencia en las plantaciones.
Para la variable icd, Negreros-Castillo et al. (2010) indican que la calidad de las plántulas está ligada con el potencial de crecimiento una vez que se haya hecho el trasplante en campo, ya que al sembrar plántulas de calidad se pueden disminuir, de manera drástica, los resultados de los agentes limitantes en la zona de plantación, tanto en el establecimiento como en el crecimiento inicial. Esto indica que la aplicación de fertilizantes orgánicos combinados genera plantas de mayor altura y mayor grosor en el tallo, ya que el estímulo de los nutrimentos esenciales de la fertilización orgánica posiblemente promueve un pronto crecimiento de las plántulas. Estos resultados coinciden con los obtenidos por Constantino et al. (2010), quienes observaron una mejora en el crecimiento de plántulas de papaya con el uso de hma y rizobacterias.
Otros trabajos realizados con bacterias u hongos han registrado un aumento en la absorción de elementos nutritivos por las plantas (Sangabriel-Conde et al., 2010). En relación con lo anterior, Sánchez-Herrera et al. (2017) y Quiñonez Bustos et al. (2020) reportan que con la aplicación de guano de murciélago se alcanzan mejores efectos y se incrementa el crecimiento de los cultivos.
Conclusiones
La fertilización orgánica y el uso de biofertilizantes en el cultivo de plántulas de papaya cv. Maradol tuvieron efectos significativos entre tratamientos. Los índices morfológicos más altos se lograron cuando se aplicaron a las plántulas las combinaciones de los cinco biofertilizantes, mientras que su aplicación por separado produjo efectos significativos sobre variables aisladas, por lo que se recomienda su combinación para obtener una mejor calidad de plántulas de C. papaya.
Referencias
Alcántara Jiménez, J. Á., Aguilar Carpio, C., Leyva Bautista, S. y Alcántara Nazario, Á. O. (2019). Yield and profitability of papaya genotypes based on chemical, organic and biological fertilization. Revista Mexicana de Ciencias Agrícolas, 10(3), 575-584. https://doi.org/10.29312/remexca.v10i3.1498
Álvarez-Sánchez, E., Vázquez-Alarcón, A., Castellanos, J. Z. y Cueto-Wong, J. (2006). Efectividad biológica de abonos orgánicos en el crecimiento de trigo. Terra Latinoamericana, 24(2), 261-268. https://www.redalyc.org/pdf/573/57311108013.pdf
Aly, M. M., El-Sayed, H., El-Sayed, A. y Jastaniah, S. D. (2012). Synergistic effect between Azotobacter vinelandii and Streptomyces sp. isolated from saline soil on seed germination and growth of wheat plant. Journal of American Science, 8(5), 667-676. https://shorturl.at/TZrYP
Armenta-Bojórquez, A. D., García-Gutiérrez, C., Camacho-Báez, J. R., Apodaca-Sánchez, M. A., Gerardo-Montoya, L. y Nava-Pérez, E. (2010). Biofertilizantes en el desarrollo agrícola de México. Ra Ximhai. Revista de Sociedad, Cultura y Desarrollo Sustentable, 6(1), 51-56. https://www.redalyc.org/pdf/461/46112896007.pdf
Battacharyya, D., Babgohari, M. Z., Rathor, P. y Prithiviraj, B. (2015). Seaweed extracts as biostimulants in horticulture. Scientia Horticulturae, 30(196), 39-48. https://doi.org/10.1016/j.scienta.2015.09.012
Birchler, T., Rose, R. W., Royo, A. y Pardos, M. (1998). La planta ideal: revisión del concepto, parámetros definitorios e implementación práctica. Investigación Agraria: Sistemas de Recursos Forestales, 7(1-2), 109-121. https://compostamasvi.com/ebooks/plantaideal.pdf
Cano, P. A. y Cetina A. V. M. (2004). Calidad de planta en vivero y prácticas que influyen en su producción. Campo experimental Saltillo-inifap-cirne (Folleto técnico, n° 12).
Constantino, M., Gómez-Álvarez, R., Álvarez-Solís, J. D., Pat-Fernández, J. y Espín, G. (2010). Efecto de la biofertilización y los biorreguladores en la germinación y el crecimiento de Carica papaya L. Revista Colombiana de Biotecnología, xii(2), 103-115. http://www.scielo.org.co/scielo.php?script=sci_arttext&pid=S0123-34752010000200008
Crouch, I. J. y van Staden, J. (1993). Evidence for the presence of plant growth regulators in commercial seaweed products. Plant Growth Regulation, 13, 21-29. https://doi.org/10.1007/BF00207588
Food and Agriculture Organization of the United Nations (2013). El manejo del suelo en la producción de hortalizas con buenas prácticas agrícolas. fao. https://www.fao.org/4/i3361s/i3361s.pdf
García, M. A. (2010). Guía técnica del cultivo de la papaya. Programa mag-centa-Frutales/Centro Nacional de Tecnología Agropecuaria y Forestal “Enrique Álvarez Córdova”. https://webquery.ujmd.edu.sv/siab/bvirtual/BIBLIOTECA%20VIRTUAL/DOCUMENTOS%20WEB/0002534-ADDOCGG.pdf
Helms, D. R., Helms, C. W., Kosinski, R. J. y Cummings, J. R. (1997). Biology in the laboratory. W. H. Freeman & Company.
Herrera Haro, J. G. y García Artiga, C. (2019). Bioestadística en ciencias veterinarias: procedimientos de análisis de datos con sas. Diamante.
Meneses Moreno, N. (2017). Agrohomeopatía como alternativa a los agroquímicos. Revista Médica de Homeopatía, 10(1), 9-13. https://doi.org/10.1016/j.homeo.2017.04.004
Milanés Figueredo, M., Rodríguez González, H., Ramos Gálvez, R. y Rivera Amita, M. M. (2005). Efectos del compost vegetal y humus de lombriz en la producción sostenible de capítulos florales en Calendula officinalis L. y Matricaria recutita L. Revista Cubana de Plantas Medicinales, 10(1), sp. http://ref.scielo.org/g769r3
Monib, M., Abd-el-Malek, Y., Hosny, I. y Fayez, M. (1979). Effect of Azotobader inoculation on plant growth and soil nitrogen. Zentralblatt, 134(2), 140-148. https://doi.org/10.1016/S0323-6056(79)80040-3
Montoya Oliver, J. M. y Cámara Obregón, A. (1996). La planta y el vivero forestal. Mundi-Prensa.
Montgomery, D. C. (2005). Diseño y análisis de experimentos. Limusa Wiley.
Muñoz-Márquez, E., Macías-López, C., Franco-Ramírez, A., Sánchez-Chávez, E., Jiménez-Castro, J. y González-García, J. (2009). Identificación y colonización natural de hongos micorrízicos arbusculares en nogal. Terra Latinoamericana, 27(4), 355-361. http://www.redalyc.org/articulo.oa?id=57313040010
Nava-Gutiérrez, Y., Ferrera-Cerrato, R. y Santamaría, J. M. (2012). Glomus intraradices attenuates the negative effect of low Pi supply on photosynthesis and growth of papaya Maradol plants. Journal of Botany, 2012(1), 1-8. https://doi.org/10.1155/2012/129591
Ndiaye, E. L., Sandeno, J. M., Mcgrath, D. y Dick, R. P. (2000). Integrative biological indicators for detecting change in soil quality. American Journal of Alternative Agriculture, 15(1), 26-36. https://doi.org/10.1017/S088918930008432
Negreros-Castillo, P., Apodaca-Martínez, M. y Mize, C. W. (2010). Efecto de sustrato y densidad en la calidad de plántulas de cedro, caoba y roble. Madera y Bosques, 16(2), 7-18. https://doi.org/10.21829/myb.2010.1621169
Povero, G., Mejía, J. F., Di Tommaso, D., Piaggesi, A. y Warrior, P. (2016). A Systematic approach to discover and characterize natural plant biostimulants. Frontiers in Plant Science, 7, 435. https://doi.org/10.3389/fpls.2016.00435
Prieto Ruiz, J. A., Vera Castillo, G. y Bermúdez Enrique, M. (1999). Factores que influyen en la calidad de brinzales y criterios para su evaluación en vivero. Campo Experimental Valle del Guadiana-inifap-sagarpa (Folleto Técnico, n° 12).
Quiñones-Aguilar, E. E., Hernández Cuevas, L. V., López Pérez, L. y Rincón Enríquez, G. (2019). Efectividad de hongos micorrízicos arbusculares nativos de rizósfera de Agave como promotores de crecimiento de papaya. Terra Latinoamericana, 37(2), 163-174. https://doi.org/10.28940/terra.v37i2.397
Quiñones-Aguilar, E. E., López-Pérez, L. y Rincón-Enríquez, G. (2014). Dinámica del crecimiento de papaya por efecto de la inoculación micorrízica y fertilización con fósforo. Revista Chapingo: Serie Horticultura, 20(2), 223-237. https://doi.org/10.5154/r.rchsh.2013.05.018
Quiñonez Bustos, J., Tandazo-Garcés, J. y Arias Mínda, J. (2020). Producción de pimiento (Capsicum annuum L.) mediante la aplicación de abonos orgánicos. Journal of Science and Research, 5(3), 42-48. https://doi.org/10.5281/zenodo.3926919
Reyes Castañeda, P. (2004). Bioestadística aplicada: agronomía, biología, química. Trillas.
Rodríguez Trejo, D. A. (2008). Indicadores de calidad de planta forestal. Mundi-Prensa.
Román, P., Martínez, M. M. y Pantoja, A. (2013). Manual de compostaje del agricultor. Experiencias en América Latina. fao. https://www.fao.org/4/i3388s/i3388s.pdf
Sáenz Reyes, J. T., Muñoz Flores, H. J., Pérez D., C. M. Á., Rueda Sánchez, A. y Hernández Ramos, J. (2014). Calidad de planta de tres especies de pino en el vivero “Morelia”, estado de Michoacán. Revista Mexicana de Ciencias Forestales, 5(26), 98-111. https://www.scielo.org.mx/pdf/remcf/v5n26/v5n26a8.pdf
Sánchez López, D. B. y Pérez Pazos, J. V. (2018). Caracterización y evaluación de pgprs sobre el crecimiento de plántulas de Dioscorea rotundata in vitro. Agronomía Costarricense, 42(2), 75-91. https://doi.org/10.15517/rac.v42i2.33780
Sánchez-Herrera, S. G., Rodríguez-Martínez, N. y Justo-Segovia, V. M. (2017). Evaluación agronómica del rábano fertilizado con guano de murciélago. Revista de Operaciones Tecnológicas, 1(4), 63-68. https://www.ecorfan.org/taiwan/research_journals/Operaciones_Tecnologicas/vol1num4/Revista_de_Operaciones_Tecnologicas_V1_N4_7.pdf
Sangabriel-Conde, W., Trejo-Aguilar, D., Soto-Estrada, A., Ferrera-Cerrato, R. y Lara-Capistrán, L. (2010). Potencial de colonización de hongos micorrícico-arbusculares en suelos cultivados con papayo bajo diferentes manejos de producción. Revista Mexicana de Micología, 31(1), 45-52. https://doi.org/10.33885/sf.2010.3.1061
Valencia Sandoval, K., Duana Ávila, D. y Hernández Gracia, T. J. (2017). Estudio del mercado de papaya mexicana: un análisis de su competitividad (2001-2015). Suma de Negocios, 8(18), 131-139. https://doi.org/10.1016/j.sumneg.2017.10.002