Inventio
Vol. 19, núm. 49, 2023
doi: http://doi.org/inventio/10.30973/2023.19.49/4
De vacunas y adyuvantes: los guerreros que nos protegen de infecciones
Of vaccines and adjuvants: the warriors that protect us from infections
Gladis Fragoso
orcid: 0000-0003-3885-1858, gladis@iibiomedicas.unam.mx
Instituto de Investigaciones Biomédicas (iib), Universidad Nacional Autónoma de México (unam)
Gabriela Rosas-Salgado
orcid: 0000-0002-9902-308X, gabriela.rosas@uaem.mx
Facultad de Medicina, Universidad Autónoma del Estado de Morelos (uaem)
Gabriela Meneses-Ruiz
orcid: 0000-0003-4307-8185, gabriela.meneses@salud.gob.mx
Instituto de Diagnóstico y Referencia Epidemiológicos (indre), Secretaría de Salud (ssa)
Raúl J. Bobes
orcid: 0000-0003-2553-5661, rbobes@biomedicas.unam.mx
Instituto de Investigaciones Biomédicas (iib), Universidad Nacional Autónoma de México (unam)
Edda Sciutto
orcid: 0000-0001-5608-5355, edda@unam.mx
Instituto de Investigaciones Biomédicas (iib), Universidad Nacional Autónoma de México (unam)
resumen
Las vacunas constituyen una de las herramientas más valiosas en la historia de la medicina, pues han permitido prevenir una gran cantidad de infecciones virales y bacterianas. Actualmente, permiten evitar de dos a tres millones de muertes cada año en la población humana. En este artículo se presenta un breve recorrido por la historia de las vacunas, así como detalles de su formulación en términos de las moléculas con que se desarrollan, que se denominan inmunógenos y adyuvantes. Los inmunógenos desencadenan una respuesta inmune específica contra el agente infeccioso y los adyuvantes potencian la respuesta inmune que se produce. Este artículo presenta la complejidad detrás del funcionamiento de las vacunas y los mecanismos inmunológicos a que dan lugar.
palabras clave
vacunas, adyuvantes, medicina preventiva
abstract
Vaccines are one of the most valuable tools in the history of medicine, as they have made it possible to prevent numerous viral and bacterial infections. They currently prevent 2-3 million deaths every year in the human population. In this article we present a brief overview of the history of vaccines, as well as details of their formulation in terms of the molecules with which they are developed, termed as immunogens and adjuvants. Immunogens triggers a specific immune response against the infectious agent and adjuvants enhance the resulting immune response. This article presents the complexity behind the working of vaccines and the immunological mechanisms they give rise to.
key words
vaccines, adjuvants, preventive medicine
Recepción: 28/08/23. Aceptación: 19/01/24. Publicación: 03/05/24.
De vacunas y adyuvantes: los guerreros que nos protegen de infecciones
La pandemia de covid-19 modificó muchos aspectos de la vida en el mundo y tuvo un impacto enorme en lo social, lo económico y lo educativo (Naseer et al., 2023; Majid et al., 2023; Laddu et al., 2023). Desde el comienzo de la pandemia hubo múltiples esfuerzos en empresas farmacéuticas y universidades para aportar herramientas dirigidas al diagnóstico, tratamiento y, muy importante, la prevención de la enfermedad. Contra lo que podría esperarse, la meta se alcanzó.
Gracias a los avances en la investigación en vacunas que se habían acumulado en los años previos a la pandemia fue posible el desarrollo, en un tiempo récord, de vacunas clásicas y de nueva generación, esto es, vacunas de virus inactivado, de rna (ácido ribonucleico), asociadas con vectores virales y, más recientemente, basadas en dna (ácido desoxirribonucleico) y proteínas recombinantes (Mohseni Afshar et al., 2022). Este logro, aunado a la prontitud de la aprobación para su uso en emergencias, redujo drásticamente la mortalidad por covid-19 y nos permitió restablecer progresivamente nuestras actividades, hasta alcanzar niveles comparables con los previos a la pandemia. El impacto de las vacunas es incuestionable, y una vez más nos recuerda la importancia de estas herramientas en la prevención de enfermedades y de la muerte (Waldman et al., 2021).
El éxito de las vacunas para cambiar el curso de una enfermedad no se limita al covid-19. Basta señalar el esfuerzo mundial coordinado para el uso extensivo y sostenido de la vacuna contra la viruela, que permitió en 1980 su erradicación en el mundo (Kirby, 2020). Otro ejemplo de éxito es la vacuna contra la poliomielitis. Hoy en día sólo se registran poco más de cien casos de niños con polio en el mundo, gracias a los planes de vacunación sostenidos (Groce et al., 2021).
Los primeros registros del desarrollo de vacunas datan del siglo xv, en Oriente, donde se inducía la protección contra la viruela después de practicar un proceso llamado variolización, por el que se exponía a individuos a material procedente de las pústulas de enfermos infectados (Saleh, 2021). Si bien hubo intentos de extender el uso de estos procedimientos, el hecho de que algunos individuos aún contrajeran la enfermedad limitó su adopción en Occidente (Plotkin, 2014).
Apenas en el siglo xvii se reportó, en el foro de la Royal Society of London, la práctica de colocar material de pústulas de viruela desecadas en las narinas de individuos que no hubieran sufrido la infección, con el fin de generar protección contra la enfermedad. Los primeros reportes provinieron de médicos que, por razones circunstanciales, residieron en lugares donde esta práctica se había utilizado hacía centenares de años, en China, India y Constantinopla (hoy Turquía). Sin embargo, en Occidente esta práctica comenzó a aplicarse durante la epidemia de 1721 en Boston, promovida por el médico Cotton Mather, y en Inglaterra, impulsada por Lady Mary, esposa del embajador en Constantinopla.
Desde los príncipes de Gales hasta prisioneros y niños de un orfanatorio recibieron la vacuna, y aunque muchos enfermaron gravemente, todos los primeros inoculados se recuperaron por completo y no volvieron a enfermarse de viruela. Esto promovió la aplicación más extensa de este procedimiento, en particular entre las clases dominantes. A pesar de los éxitos iniciales, prevaleció un gran escepticismo al respecto, por lo que durante los quince años siguientes sólo se vacunó a cerca de mil personas, con una tasa de mortalidad cercana a 2%. Aunque este porcentaje distaba mucho del riesgo de mortalidad por la infección, su mera existencia fortaleció los movimientos contra la inoculación, que siguieron creciendo sostenidos principalmente por líderes religiosos, que la consideraban una práctica contraria a las leyes religiosas y la naturaleza (Silverstein y Genevieve, 2009).
Cuando Benjamin Jesty logró demostrar que la infección por viruela bovina (causada por el virus bovino de viruela) podía proteger a una persona frente al virus de la viruela humana, estos procedimientos retomaron interés. Años más tarde, el médico inglés Edward Jenner profundizó en ese descubrimiento e inoculó a un niño con material de una úlcera de viruela bovina sin causarle la enfermedad. Posteriormente, lo infectó con material de una úlcera de viruela humana sin que el niño se enfermara. La viruela era muy contagiosa y se propagaba de una persona a otra, dejando cicatrices permanentes e incluso provocando la muerte (Kayser y Ramzan, 2021).
El experimento de Jenner sentó las bases de lo que se conoce como vacunas, término que señala la procedencia del material utilizado para protección de las úlceras de las vacunas por viruela bovina y su efecto protector contra enfermedades infecciosas (Desmond y Offit, 2021).
A partir de estos hallazgos se ha desarrollado una gran cantidad de vacunas, no sólo para combatir enfermedades infecciosas, sino también para controlar enfermedades no infecciosas, como el cáncer (Desmond y Offit, 2021). La figura 1 muestra en una línea del tiempo las vacunas que se han desarrollado para uso humano, desde la propuesta por Jenner hasta las emergentes para combatir el virus sars-cov-2.
Muchas de las vacunas incluidas en esta figura se aplican en la infancia, entre ellas, las vacunas contra la tuberculosis bcg (bacilo de Calmette-Guérin) y contra la hepatitis b; la pentavalente contra la difteria, tosferina, tétanos, poliomielitis e infecciones causadas por Haemophilus influenzae; la triple o dtp (tetánico y diftérico) —como refuerzo de la inmunización contra la difteria, tosferina y tétanos—, y contra rotavirus, influenza, neumococo, sarampión y rubeola.
La vacunación contra estas enfermedades previene por completo la infección o reduce su gravedad, al generar una respuesta inmune específica contra el patógeno para el que se desarrolló. Esta inmunidad se sostiene en el tiempo, fenómeno que se ha llamado memoria inmunológica. Cuando el individuo entra en contacto con el patógeno en cuestión, esta respuesta de memoria establece rápidamente una inmunidad específica robusta, capaz de limitar la infección y prevenir la enfermedad (Pulendran y Ahmed, 2011).
Figura 1
Línea del tiempo del descubrimiento de las vacunas más importantes para uso humano
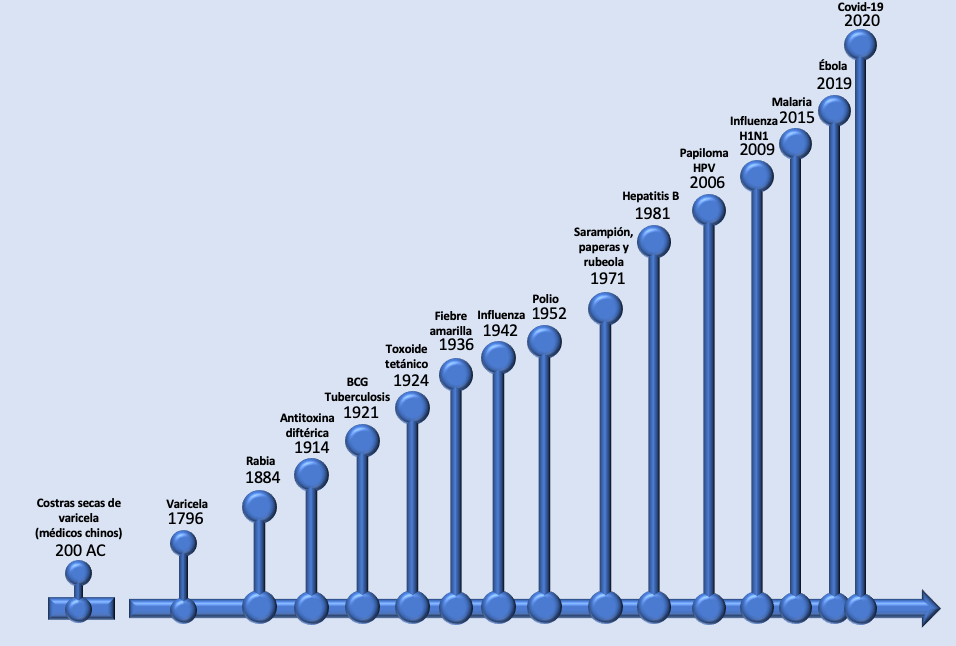
Fuente: elaboración propia con base en Saleh et al. (2021).
Tipo y composición de las vacunas contra agentes infecciosos
Las vacunas pueden estar constituidas por bacterias o virus completos, ya sea atenuados, inactivados o muertos, o bien por fracciones de ellos, o incluso por partículas proteicas, polisacáridos o ácidos nucleicos de estos patógenos. Al administrarse, éstos pueden activar las células linfoides del sistema inmunológico (linfocitos t y covid), lo que promueve una respuesta inmune específica capaz de neutralizar o eliminar el patógeno en cuestión, previniendo así la enfermedad (figura 2).
Estas moléculas, que provocan que el sistema inmunitario produzca una respuesta inmune específica contra ellas, se conocen como antígenos (Abbas et al., 2022). En el caso de las vacunas basadas en el patógeno completo atenuado, la vacunación genera infección pero no causa la enfermedad. Este tipo de vacunas puede ser muy eficiente porque es capaz de inducir una repuesta contra múltiples componentes del patógeno y dejar así una memoria inmunológica robusta. Tal es el caso de la vacuna Sabin, de administración oral, basada en el virus atenuado, la cual genera una infección asintomática en el intestino y despierta la inmunidad, en particular en las mucosas, lo que protege de forma efectiva contra la enfermedad (Orenstein et al., 2022).
Por otro lado, en las vacunas inactivadas el virus no es capaz de infectar ni de dividirse, y si bien expone muchos de sus antígenos, en general la inmunidad no es tan efectiva como en las atenuadas, pero es muy segura y no permite que el virus se modifique (revisado por Mbani et al., 2023). Este es el caso de la vacuna inyectable Salk contra la polio y de varias vacunas contra el covid-19, como las de Sinovac y Sinopharma (Orenstein et al., 2022). También existen vacunas que sólo usan parte de los componentes del patógeno, desde un conjunto limitado, como la de la influenza, hasta sólo alguno de sus componentes más críticos o proteínas producidas en forma recombinante para garantizar que estén disponibles en muy altas cantidades, como la de la hepatitis (Mahmood et al., 2023).
Las vacunas basadas en una o unas pocas proteínas pueden, además, producirse asociadas a virus modificados genéticamente, para que no generen daño en el individuo (Travieso et al., 2022). Estas vacunas de nueva generación tienen la virtud de que pueden producirse muy rápidamente, lo que las hace relevantes para responder a emergencias, como la de la pandemia del covid-19. Hoy en día también disponemos de vacunas formuladas con los ácidos nucleicos, dna o rna. Éstos deben introducirse en las células del individuo vacunado, donde utilizarán las herramientas de la propia célula para generar la proteína en cuestión. Una vez que salga de la célula, esta proteína inducirá la respuesta inmune específica (Qin et al., 2021).
Como mencionamos, este mecanismo para provocar una respuesta inmune específica contra del patógeno requerido es, en general, más eficiente cuando se utilizan virus o bacterias completas que con las vacunas subunitarias, que emplean proteínas, péptidos o ácidos nucleicos (figura 2).
Para paliar esta desventaja, en las vacunas subunitarias se requieren componentes adicionales que incrementen la respuesta inmune específica. Este tipo de sustancias auxiliares, conocidas como adyuvantes, se han reconocido como los héroes silenciosos de las vacunas, pues son los Hércules que pueden aumentar la eficiencia de la inmunización, y con ello, la intensidad y duración de la respuesta específica (figura 3). La tabla 1 muestra los tipos de adyuvantes, agrupados según su naturaleza química, y algunos ejemplos.
Figura 2
Relación entre la complejidad de las vacunas y su capacidad de inducir una respuesta inmune
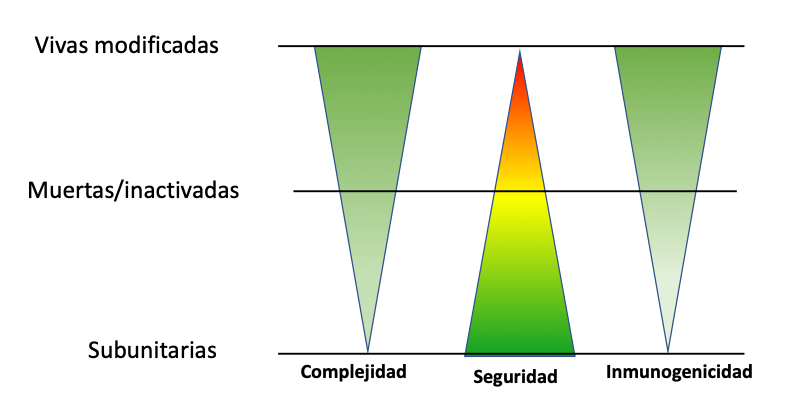
Fuente: elaboración propia.
Figura 3
Esquema hipotético que muestra el efecto de la incorporación de un adyuvante en la formulación de una vacuna sobre la intensidad de la respuesta inmune específica en distintos tiempos después de la inmunización
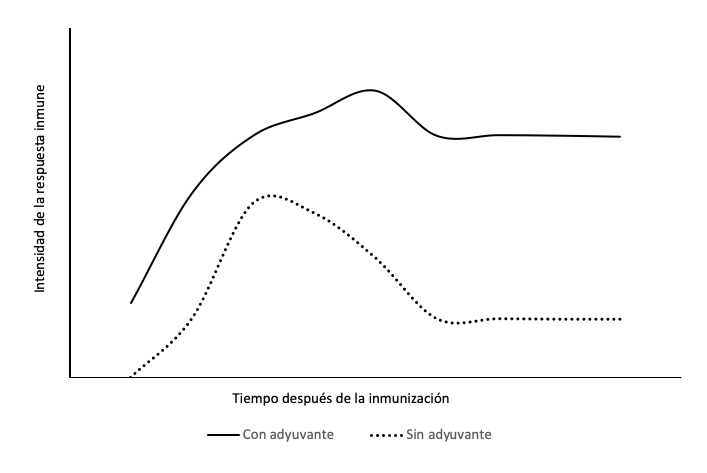
Fuente: elaboración propia.
Tabla 1
Clasificación y ejemplos de adyuvantes según su naturaleza química o mecanismo de acción
| Grupo de adyuvantes | Ejemplos |
|---|---|
| Sales de aluminio | a1ooh, a1po4, a1(so4)2, 12 h2o |
| Productos bacterianos | Lipopolisacárido (lps) Monofosforil lípido a (mpla) Trehalosa dimicolato de micobacterias Muramil dipéptido Toxina de pertussis |
| Emulsiones aceite en agua (o/w) | Adyuvante Incompleto de Freund (fia) mf59 |
| Complejos inmunoestimuladores y sistemas adyuvantes | iscoms® as01-04 de gsk s6322® sigma |
| Saponinas | Triterpenoides extraídos del árbol Quillaja saponaria |
Fuente: elaboración propia.
Adyuvantes
El término adyuvante viene del latín adiuvare, que significa “ayudar” o “potenciar”. Los adyuvantes son sustancias que pueden tener una estructura química muy variada y se utilizan para reforzar la respuesta inmune contra un antígeno. Estas sustancias se incluyen en la misma formulación de la vacuna, en cantidades adecuadas para administrarse en la misma aplicación.
El concepto de adyuvantes se exploró desde los comienzos del desarrollo de vacunas, con el objetivo de aumentar su efectividad. Las primeras evidencias experimentales se obtuvieron en el siglo pasado, en 1920, cuando el veterinario y biólogo francés Gaston Ramon se encontraba inoculando caballos con el toxoide diftérico. El médico se percató de que, cuando los caballos desarrollaban abscesos en el lugar de la inoculación, que generaban un cuadro inflamatorio, producían más anticuerpos específicos que los caballos vacunados en condiciones asépticas, los cuales no desarrollaban un proceso inflamatorio en el sitio de administración del toxoide (Plotkin, 2014).
Un año más tarde, el inmunólogo británico Alexander Glenny usó sales de aluminio para purificar la proteína de la difteria y observó que esta preparación generaba una mejor respuesta que la alcanzada por la sola administración del toxoide tetánico (Plotkin, 2014). Los estudios de Glenny fueron fundamentales para el uso de las sales de aluminio como adyuvantes, con las que actualmente aún se formulan muchas vacunas. Con base en las observaciones de Ramon, el microbiólogo Jules Freund desarrolló uno de los adyuvantes más potentes, que se emplea en la investigación experimental de distintas vacunas. El adyuvante desarrollado por Freund, conocido como Adyuvante Completo de Freund (fca en inglés), consistía en una emulsión de agua en aceite mineral que contenía micobacterias muertas (Plotkin, 2014; comentado por Lowe, 2023).
Sin embargo, dada su alta capacidad inflamatoria, que promueve la formación de un granuloma por la presencia de los antígenos de las micobacterias, Stuart-Harris propuso retirar el antígeno micobacteriano, lo que dio lugar al fca, el cual ha sido aceptado para su uso en el área veterinaria y en estudios de experimentación animal (Jensen et al., 1998). A partir de los estudios de Ramon y Glenny se han desarrollado diversos adyuvantes, algunos de los cuales se han autorizado para uso humano, como se ilustra en la figura 4. Los adyuvantes se han clasificado en cinco grupos, de acuerdo con sus características generales: sales de aluminio, derivados de bacterias, emulsiones, liposomas y copolímeros de microesferas.
A partir de entonces se han utilizado adyuvantes para potenciar la capacidad inmunogénica de las vacunas. La Organización Mundial de la Salud (oms) definió en 1976 a los adyuvantes como sustancias que se adicionan a las vacunas para potenciar la respuesta inmune humoral, que aumenta la cantidad de anticuerpos, y la celular, que incrementa la inducción de células t activadas específicas contra los antígenos vacunales (oms, 1976).
El uso de adyuvantes puede permitir, además, utilizar cantidades más bajas del antígeno vacunal y reducir el número de dosis administradas sin detrimento de la inmunidad inducida. Pueden también inducir una protección más duradera y establecer una respuesta de memoria inmunológica más efectiva (Christensen, 2016). Se considera que el mejor adyuvante para la formulación de una vacuna es aquél que favorezca la inducción de una respuesta inmune persistente, potente, específica para los antígenos vacunales, y que demuestre ser estable y poco tóxico (Reed et al., 2009).
Figura 4
Línea del tiempo del descubrimiento de los adyuvantes más empleados para la formulación de vacunas para uso humano, aprobadas por la Administración de Medicamentos y Alimentos (fda) de Estados Unidos
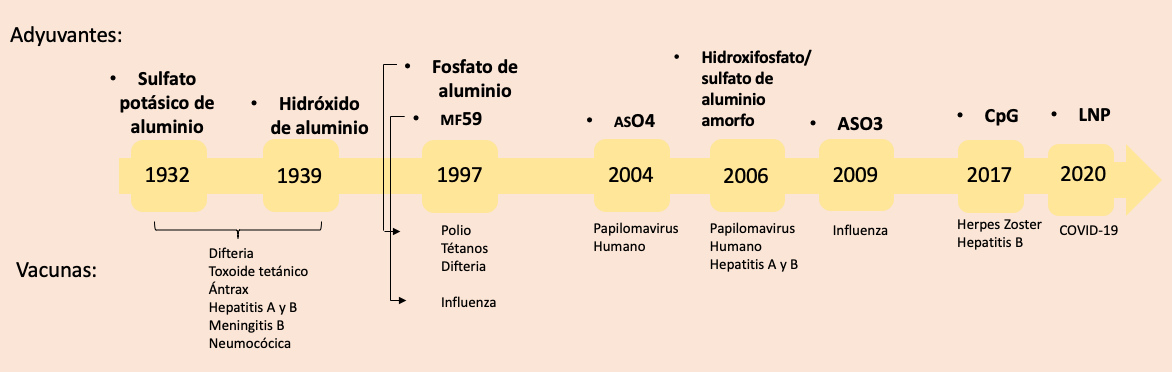
lnp (nanopartículas lipídicas); cpg (regiones del adn donde un nucleótido de citosina va seguido de un
nucleótido de guanina en la secuencia lineal).
Fuente: elaboración propia con base en Zhao et al. (2023).
Mecanismo de acción de las vacunas y los adyuvantes
Vacunas
Independientemente del tipo o la naturaleza, consistan en bacterias o virus completos, muertos,
atenuados o inactivados, o de moléculas específicas de éstos (proteínas), o bien, basadas
en ácidos nucleicos, las vacunas tienen el mismo principio de acción: activar linfocitos b y t de
la respuesta inmune específica (conocida como respuesta inmune adaptativa) (Clem, 2011).
Las células b son las encargadas de producir anticuerpos, los cuales tienen como principal función neutralizar al agente infeccioso para evitar que ingrese en las células del hospedador, o bien, unirse a él y activar mecanismos que causen su destrucción (sistema del complemento), o bien, que las células de la respuesta innata lo eliminen al engullirlo (fagocitosis) (Abbas et al., 2022; Kang y Compans, 2009).
Los linfocitos t pueden actuar de manera más compleja. Hay dos tipos: los conocidos como cd4 ayudadores y los cd8 citotóxicos. Los primeros tienen la función de producir moléculas capaces de favorecer la respuesta inmune, particularmente las conocidas como citocinas y quimiocinas. Por su parte, los linfocitos cd8, ayudados por las citocinas, pueden destruir directamente las células del hospedero que se encuentren infectadas por el microorganismo patógeno (Abbas et al., 2022; Kang y Compans, 2009).
La figura 5 ilustra los mecanismos a través de los cuales los anticuerpos y las células t pueden participar en la eliminación del agente infeccioso.
Figura 5
Esquema que ilustra la activación del sistema inmune cuando se aplica una vacuna
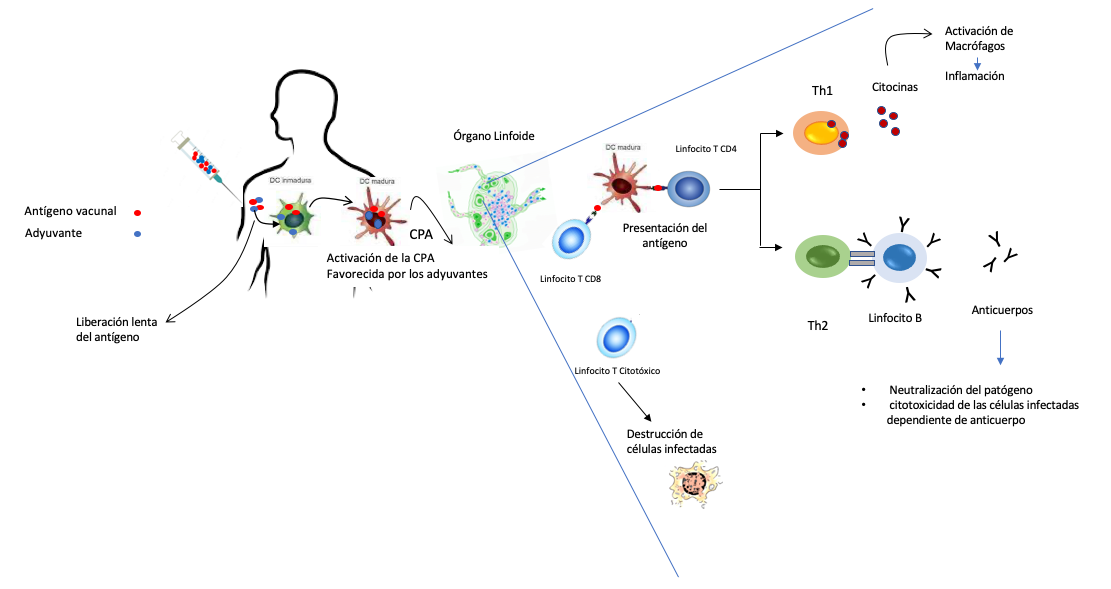
Se muestra la administración por vía intramuscular de una vacuna formulada con el antígeno y el adyuvante.
Una vez inyectado, el adyuvante permite una liberación lenta del antígeno, el cual es capturado junto con el
adyuvante por las células presentadoras de antígeno (ejemplificadas por una célula dendrítica). El adyuvante
favorece la activación de la cpa, lo que permite que la célula dendrítica pase de un estado inmaduro a
uno maduro. La célula dendrítica migra a los órganos linfoides más cercanos, donde procesa y presenta el
antígeno a los linfocitos t (cd4 o cd8). Los linfocitos t cd4 pueden polarizarse hacia linfocitos th1 (productores
de citocinas que activan a macrófagos, lo cual favorece el establecimiento de un fenómeno inflamatorio)
o th2, que producen citocinas que interactúan con las células b, lo que permite que éstas se diferencien a
células plasmáticas productoras de anticuerpos. Los anticuerpos pueden dañar las células infectadas a través
de un proceso conocido como citotoxicidad celular dependiente de anticuerpo, o bien, asociarse con el
patógeno, lo que impide que éste ingrese en una célula sana. Por su parte, los linfocitos cd8 se transforman
en células citotóxicas capaces de destruir las células infectadas por el agente infeccioso.
Fuente: elaboración propia.
Adyuvantes
A diferencia de los antígenos vacunales, los adyuvantes pueden actuar a través de mecanismos
muy variados para potenciar la respuesta de las células b y t (De Gregorio et al., 2013).
En general, pueden agruparse en adyuvantes que funcionan como immunoestimuladores
y adyuvantes que permiten una liberación lenta y sostenida del antígeno. Algunos pueden
ejercer ambas funciones. La figura 5 también ilustra el mecanismo general de cómo funcionan
ambos tipos de adyuvantes.
Los adyuvantes que permiten una liberación lenta y sostenida del antígeno actúan como un depósito del antígeno. Los de esta categoría que han sido aprobados por la Administración de Medicamentos y Alimentos de Estados Unidos (fda) incluyen sales minerales, como las de aluminio (hidróxido de aluminio, fosfato de aluminio, sulfato potásico de aluminio), y emulsiones, como las mf59, as03 y as04 (Zhao et al., 2023). Dependiendo de su naturaleza (geles o soluciones oleosas), estos adyuvantes pueden inducir un proceso inflamatorio en el sitio de administración, lo que favorece el reclutamiento de células que participan en el fenómeno inflamatorio y la activación de las células presentadoras de antígeno (fundamentales en la respuesta inmune innata, porque inician la respuesta inmune hacia un determinado antígeno), con la liberación de factores solubles, como citocinas y quimiocinas, que promueven la activación de las células, así como su permanencia en el sitio de inmunización.
Este fenómeno local de inflamación puede también estimular los linfocitos t, a través de la presentación del antígeno por parte de las células presentadoras del antígeno (cpa) en los ganglios linfáticos regionales, en particular los más cercanos al sitio de inmunización (revisado por Orenstein et al., 2022). Entre los adyuvantes que funcionan como immunoestimuladores se encuentran los que activan las cpa, que facilitan los procesos de presentación antigénica hacia los linfocitos t, para que éstos puedan adquirir capacidades especiales que les permitan ejercer sus funciones en la respuesta inmune específica contra el patógeno en cuestión.
Entre las células que funcionan como cpa se encuentran las células dendríticas, los macrófagos y los propios linfocitos b. La activación de las cpa puede darse a través del reconocimiento del adyuvante por receptores que se expresan en la superficie de las células de la respuesta innata. Estos receptores reconocen patrones moleculares asociados con patógenos y se llaman prr (pathogen recognition receptor). Entre ellos destacan los receptores tipo Toll o tlr (toll-like receptors, en inglés), que pueden estar presentes en la membrana celular o en endosomas de las células del hospedero.
Entre los adyuvantes que activan a las cpa vía tlr destacan los componentes propios de los agentes infecciosos, como el lípido monofosforil a derivado del lipopolisacárido (lps) de bacterias Gram negativas, que tiene una notoria menor toxicidad que el lps; los cpg, una forma sintética de dos bases del dna que imita el material genético de virus o bacterias, o el muramil dipéptido (mdp), un constituyente de la pared celular de bacterias tanto Gram positivas como Gram negativas, entre otros. Como se aprecia, muchas de estas moléculas son componentes de bacterias, hongos o inclusive parásitos que pueden activar a las cpa vía tlr; sin embargo, la fda no ha aprobado su uso como adyuvantes en vacunas para uso humano, porque no cumplen todos los requisitos de seguridad (Orenstein et al., 2022).
En respuesta a los mecanismos de acción de los inmunoadyuvantes, los linfocitos t pueden diferenciarse a un tipo de linfocito conocido como th1 o th2, que se diferencian entre ellos por producir un repertorio distinto de moléculas conocidas como citocinas, las cuales orquestan la comunicación celular. Así, los linfocitos th1 producen principalmente las citocinas il-2, ifn-γ e il-12, que favorecen una respuesta de activación de macrófagos con funciones inflamatorias, mientras que los linfocitos th2, que producen citocinas como il-4, il-5 e il-10, favorecen la síntesis de anticuerpos igg, iga e ige. Por ejemplo, el hidróxido de aluminio y el mf59 tienen efecto polarizador hacia th2, mientras que el monofosforil lípido a polariza hacia th1 (Facciolà et al., 2022).
Para recordar…
Las vacunas constituyen el producto biotecnológico más poderoso para la prevención de enfermedades infecciosas. El desarrollo y la aplicación de vacunas ha prevenido, desde su descubrimiento, la muerte de millones de individuos, tanto en humanos como en la población animal. La vacunación ha permitido la erradicación de la viruela y el control eficiente de muchas enfermedades, como la polio, el sarampión y el covid-19. El avance continuo de la investigación en el área y las inversiones millonarias en el mundo han permitido desarrollar nuevas formulaciones de vacunas y adyuvantes, que aseguran respuestas cada vez más eficientes contra los patógenos, con costos que hacen factible proteger a toda la población humana.
No todo es éxito…
A pesar de los esfuerzos y estudios realizados, aún hay patógenos que producen enfermedades graves para las que no se ha podido desarrollar aún vacunas. En algunos casos, como el sida, la dificultad es que el patógeno mismo habita en nuestras células inmunes, lo que dificulta la inducción de una respuesta efectiva sin un alto costo para el individuo receptor. Otros patógenos han adquirido una capacidad enorme de modificar su composición, y utilizan este mecanismo para que la inducción de una respuesta específica contra ciertos blancos sea irrelevante, porque ya no los expresan, como es el caso de la malaria.
En el caso del covid-19, el virus continúa cambiando. Esto representa un desafío para mantener la inmunidad poblacional sostenida a niveles efectivos. Por eso, en el mundo siguen supervisándose las nuevas variantes y la capacidad de controlarlas con la inmunidad inducida contra las variantes originales. A esto responde la actualización de la composición de las vacunas: para mantener a la humanidad a salvo de este patógeno.
Referencias
Abbas, A. K., Lichtman, A. H. y Pillai, S. (2022). Cellular and molecular immunology. Elsevier. https://shop.elsevier.com/books/cellular-and-molecular-immunology/abbas/978-0-323-75748-5
Clem, A. S. (2011). Fundamentals of vaccine immunology. Journal of Global Infectious Disease, 3(1), 73-8. https://doi.org/10.4103/0974-777X.77299
Christensen, D. (2016). Vaccine adjuvants: Why and how. Human Vaccines & Immunotherapeutics, 12(10), 2709-2711. https://doi.org/10.1080/21645515.2016.1219003
De Gregorio, E., Caproni, E., Ulmer, J. B. (2013). Vaccine adjuvants: mode of action. Frontiers in Immunology, 4, 214. https://doi.org/10.3389/fimmu.2013.00214
Desmond, A. y Offit, P. A. (2021). On the shoulders of giants—from Jenner’s cowpox to mrna covid vaccines. New England Journal of Medicine, 384(12), 1081-1083. https://doi.org/10.1056/NEJMp2034334
Facciolà, A., Visalli, G., Laganà, A. y Di Pietro, A. (2022). An overview of vaccine adjuvants: current evidence and future perspectives. Vaccines, 10(5), 819. https://doi.org/10.3390/vaccines10050819
Groce, N. E., Banks, L. M. y Stein, M. A. (2021). The global polio eradication initiative-polio eradication cannot be the only goal. Lancet Glob Health, 9(9), e1211. http://doi.org/10.1016/S2214-109X(21)00314-4
Jensen, F. C., Savary, J. R., Diveley, J. P. y Chang, J. C. (1998). Adjuvant activity of incomplete Freund’s adjuvant. Adv Drug Deliv Rev, 32(3), 173-186. https://doi.org/10.1016/s0169-409x(98)00009-x
Kang, S. M. y Compans, R. W. (2009). Host responses from innate to adaptive immunity after vaccination: molecular and cellular events. Molecules and Cells, 27(1), 5-14. https://doi.org/10.1007/s10059-009-0015-1
Kayser, V. y Ramzan, I. (2021). Vaccines and vaccination: history and emerging issues. Human Vaccines Immunotherapeutics, 17(12), 5255-5268. https://doi.org/10.1080/21645515.2021.1977057
Kirby, T. (2020). who celebrates 40 years since eradication of smallpox. The Lancet Infectious Diseases, 20(2), 174. https://doi.org/10.1016/S1473-3099(20)30012-8
Laddu, D. R., Biggs, E., Kaar J., Khadanga S., Alman, R. y Arena R. (2023). The impact of the covid-19 pandemic on cardiovascular health behaviors and risk factors: a new troubling normal that may be here to stay. Progress in Cardiovascular Diseases, 76, 38-43. http://doi.org/10.1016/j.pcad.2022.11.017
Lowe, D. (2023). Enhancing the Enhancers in Vaccines. Science. https://www.science.org/content/blog-post/enhancing-enhancers-vaccines
Mahmood, F., Xu, R., Awan, M. U. N., Song, Y., Han, Q., Xia, X., Wei, J., Xu, J., Peng, J. y Zhang, J. (2023). hbv vaccines: advances and development. Vaccines, 11(12), 1862. https://doi.org/10.3390/vaccines11121862
Majid, U., Shahzaeem Hussain, S. A., Zahid, A., Hasnain Haider, M. y Arora, R. (2023). Mental health outcomes in health care providers during the covid-19 pandemic: an umbrella review. Health Promotion International, 38(2), 1-11. http://doi.org/10.1093/heapro/daad025
Mbani, C. J., Nekoua, M. P., Moukassa, D. y Hober, D. (2023). The fight against poliovirus is not over. Microorganisms, 11(5), 1323. https://doi.org/10.3390/microorganisms11051323
Mohseni Afshar, Z., Barary, M., Hosseinzadeh, R., Karim B., Ebrahimpour, S., Nazary, K., Sio, T. T., Sullman, M. J. M., Carson-Chahhoud, K., Moudi, E. y Babazadeh, A. (2022). covid-19 vaccination challenges: a mini-review. Human Vaccines & Immunotherapeutics, 18(5), 2066425-1-9. http://doi.org/10.1080/21645515.2022.2066425
Naseer, S., Khalid, S., Parveen, S., Abbass, K., Song, H. y Achim, M. V. (2023). covid-19 outbreak: Impact on global economy. Front Public Health, 10, 1-13. https://doi.org/10.3389/fpubh.2022.1009393
Orenstein, W. A., Offit, P. A., Edwards, K. M. y Plotkin, A. (2022). Plotkin’s vaccines. Elsevier. https:// www.sciencedirect.com/book/9780323357616/plotkins-vaccines
Organización Mundial de la Salud (1976). Immunological adjuvants: report of a who scientific group [meeting held in Geneva from 6 to October 1975]. Technical Report Series No. 595. oms. https://iris.who.int/handle/10665/41209
Plotkin, S. (2014). History of vaccination. Proceedings of the National Academy Sciences, 111(34), 12283-12287. https://doi.org/10.1073/pnas.1400472111
Pulendran, B. y Ahmed, R. (2011). Immunological mechanisms of vaccination. Nature Immunology, 12(6), 509-517. http://doi.org/10.1038/ni.2039
Qin, F., Xia, F., Chen, H., Cui, B., Feng, Y., Zhang, P., Chen, J. y Luo, M. (2021). A guide to nucleic acid vaccines in the prevention and treatment of infectious diseases and cancers: from basic principles to current applications. Frontiers in Cell and Developmental Biology, 9, 633776. https://doi.org/10.3389/fcell.2021.633776
Reed, S. G., Orr, M. T. y Fox, C. B. (2013). Key roles of adjuvants in modern vaccines. Nature Medicine, 19(12), 1597-608. https://doi.org/10.1038/nm.3409
Saleh, A., Qamar, S., Tekin, A., Singh, R. y Kashyap, R. (2021). Vaccine development throughout history. Cureus, 13(7), e16635. https://doi.org/10.7759/cureus.16635
Silverstein, A. y Genevieve, M. (2009 [1989]). The Royal Experiment of Immunity. En A. M. Silverstein, A History of Immunology (pp. 24-35). Elsevier. https://www.sciencedirect.com/book/9780123705860/a-history-of-immunology
Travieso, T., Li, J., Mahesh, S., Mello, J. D. F. R. E. y Blasi, M. (2022). The use of viral vectors in vaccine development. npj Vaccines, 7, 75. https://doi.org/10.1038/s41541-022-00503-y
Waldman, S. E., Adams, J. Y., Albertson, T. E., Juárez, M. M., Myers, S. L., Atreja, A., Batra, S., Foster, E. E., Huynh, C. V., Liu, A. Y., Lubarsky, D. A., Ngo, V. T., Sandrock, C. E., Taylor, S. L., Tompkins, A. M. y Cohen, S. H. (2021). Real-world impact of vaccination on coronavirus disease 2019 (covid-19) incidence in healthcare personnel at an academic medical center. Infect Control Hosp Epidemiol, 43(9), 1194-1200. http://doi.org/10.1017/ice.2021.336
Zhao, T., Cai, Y., Jiang, Y., He, X., Wei, Y., Yu, Y. y Tian, X. (2023). Vaccine adjuvants: mechanisms and platforms. Signal Transduction and Targeted Therapy, 8, 283. https://doi.org/10.1038/s41392-023-01557-7