Inventio
Vol. 19, núm. 48, 2023
doi: http://doi.org/inventio/10.30973/2023.19.48/5
Viruela del mono: nuevo reto de salud mundial
Monkey pox: new global health challenge
Fernando R. Esquivel Guadarrama
orcid: 0000-0001-7399-4040, fernando.esquivel@uaem.mx
Facultad de Medicina, Universidad Autónoma del Estado de Morelos (uaem)
Danahi García Mejía
orcid: 0009-0003-9124-4384, danahi.garcia@uaem.edu.mx
Licenciatura en Médico Cirujano, Facultad de Medicina, Universidad Autónoma del Estado de Morelos (uaem)
resumen
El virus de la viruela del mono ha tomado un papel protagónico en el universo de las enfermedades infecciosas en los últimos dos años. La preocupación por los brotes de este virus que surgieron en distintas partes del mundo colocaron esta enfermedad en el centro de la atención pública, porque se creía que no existía tratamiento o vacuna específica para ella. La buena noticia es que su letalidad no es muy alta y existen tratamientos y medidas de prevención alternativas, creadas originalmente para el virus de la viruela humana. En este artículo se exponen los aspectos más relevantes de este virus y el curso de la enfermedad que genera, así como las medidas de tratamiento y prevención más usadas en la actualidad.
palabras clave
viruela del mono, enfermedades infecciosas, orthopoxvirus, mpox, vacunas, vigilancia epidemiológica
abstract
The monkeypox virus has taken a leading role in the universe of infectious diseases in the last two years. Concern about outbreaks of this virus that emerged in different parts of the world placed this disease in the public spotlight, because it was believed that there was no specific treatment or vaccine for it. The good news is that its lethality is not very high and that there are alternative treatments and prevention measures, originally created for the human smallpox virus. This article presents the most relevant aspects of the virus and the course of the disease it generates, as well as the most commonly used treatment and prevention measures.
key words
monkeypox, infectious diseases, orthopoxvirus, mpox, vaccines, epidemiological surveillance
Recepción: 29/03/23. Aceptación: 11/07/23. Publicación: 26/02/24.
Generalidades
La viruela humana o viruela clásica es una infección viral que, a lo largo de la historia de la humanidad, ha devastado poblaciones enteras, la cual tiene actualmente una tasa de mortalidad del 30%. En 1796, el médico inglés Edward Jenner creó una vacuna contra ella, basada en la administración del virus de la viruela bovina, al observar que las mujeres que ordeñaban a las vacas podían contraer una infección más leve o benigna con la viruela bovina y que esto les daba protección contra la viruela humana. El éxito de esta vacuna radicó en que ambos virus son muy cercanos evolutivamente, ya que pertenecen a la familia de los poxivirus, por lo que comparten propiedades antigénicas que permiten su reconocimiento por el sistema inmune.
Recientemente ha habido reportes a nivel mundial de brotes de una infección causada por el virus de la viruela del mono (vvm), que provoca una enfermedad parecida a la viruela humana pero más sutil. El vvm fue aislado por primera vez en monos en los años cincuenta del siglo pasado (Kozlov, 2022) y los primeros casos reportados del brote actual se localizaron en la República Democrática del Congo en 2019 (Petersen, Kabamba et al., 2019). De manera paulatina, la infección se fue diseminando a otros países africanos y apareció finalmente en al menos setenta países del mundo. De acuerdo con la Secretaría de Salud, desde el primer caso reportado en mayo de 2022 hasta el 17 de abril de 2023, se registraron cerca de cuatro mil casos positivos en México. Hasta el momento se han reportado más de 85 mil casos y más de noventa muertes en todo el mundo (Secretaría de Salud, 2023).
De esta manera, y en medio de la pandemia mundial de covid-19, esta infección ha generado una gran atención por parte de los organismos encargados de la salud pública mundial, por lo que es de gran importancia conocer la biología de la infección para determinar las mejores medidas preventivas y terapéuticas.
Virus y patología
Como ya se mencionó, el vvm pertenece al género Orthopoxvirus y a la familia Poxviridae. Es un virus con envoltura lipídica que adopta una forma ovoide y estructura de ladrillo (Ryan at al., 2022). Mide entre 220 y 450 nanómetros de largo y de 140 a 260 nanómetros de ancho, lo cual lo coloca entre los virus más grandes (figura 1).
Figura 1
Estructura del virus de la viruela del mono
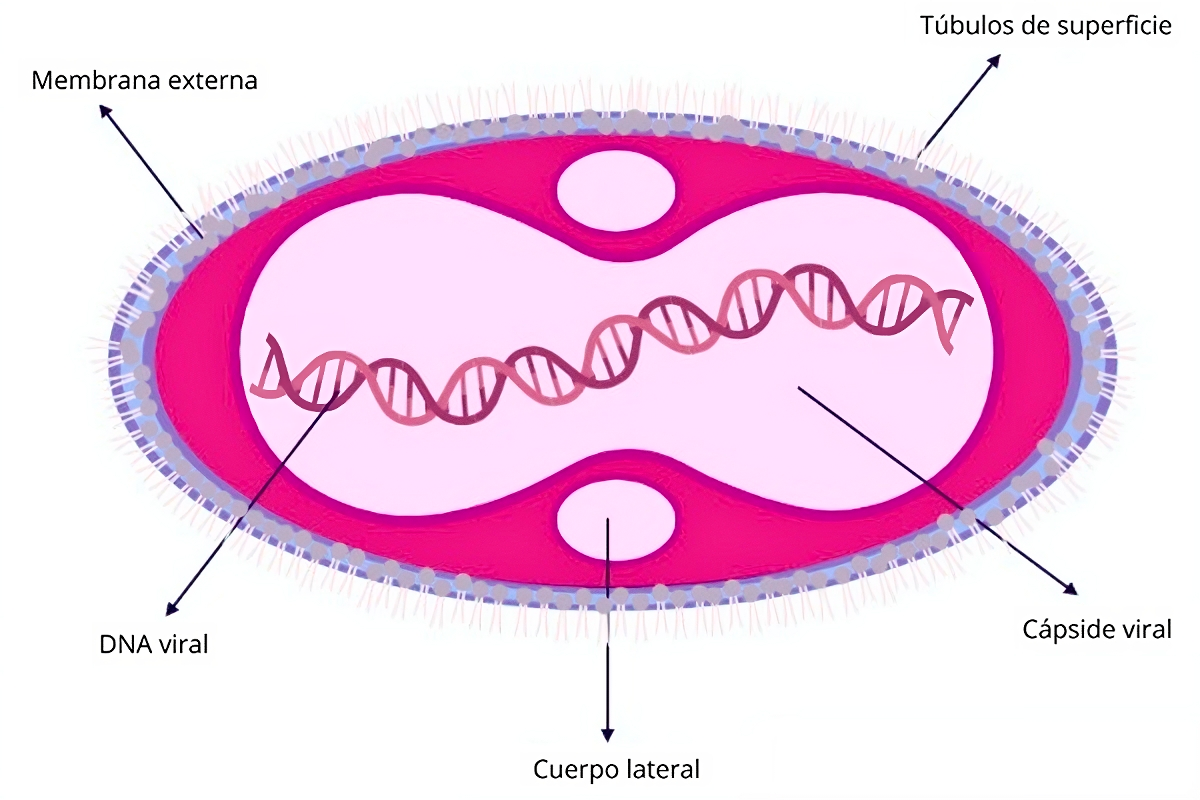
Fuente: Elaboración propia.
Al ser un virus de gran tamaño, codifica para las enzimas y factores esenciales para su replicación gracias a su material genético, que está constituido por una cadena de adn linear. Para infectar, se une a los glicosoaminoglicanos, que se encuentran en la membrana celular, y entra en la célula por medio de las vesículas llamadas endosomas. Posteriormente, libera su material genético en el citoplasma, donde se lleva a cabo la replicación gracias a una enzima denominada rna polimerasa, dependiente de dna. Este proceso se compone por tres fases: temprana, media y tardía, en un promedio de tiempo que ronda entre los 120 minutos y las 48 horas posinfección (Moss, 2013). No se han encontrado aún los receptores celulares específicos para el reconocimiento del vvm, no obstante, podemos hablar de cuatro proteínas virales de membrana que participan en el proceso de entrada a las células: e8, a29, a28 y h3 (Gong et al., 2022).
Al igual que la replicación, el ensamblaje se lleva a cabo en el citoplasma, donde adquiere su forma ovoide en etapa inmadura y de ladrillo al madurar. Posteriormente, el virus sale de la célula mediante lisis, es decir, rotura de membrana, lo cual suele desencadenar la muerte celular.
A pesar de su denominación, su reservorio primario no son los primates, sino roedores provenientes de África central y occidental, entre ellos, los perritos de la pradera (Di Giulio y Eckburg, 2004). Este virus se propaga de animales a humanos por medio de contacto directo, ya sea con fluidos corporales, como la saliva, o lesiones vesículo-pustulosas. El periodo de incubación comprende entre siete y catorce días, con un máximo de veintiún días. Las primeras manifestaciones clínicas incluyen síntomas parecidos a los de la influenza (Kozlov, 2022), como fiebre, malestar general y dolor de cabeza, acompañados característicamente de inflamación en los ganglios linfáticos, sobre todo los inguinales, ubicados en la entrepierna (Gong et al., 2022) (tabla 1). Las erupciones cutáneas propias del vvm suelen verse en los primeros cinco días después de la aparición de la fiebre, y es a partir de esta fase cuando el paciente puede contagiar a otras personas.
Tabla 1
Curso de la sintomatología en la infección por virus de la viruela del mono
| Fase | Tiempo | Síntomas |
|---|---|---|
| Fase de incubación | Día 7-14 | No hay manifestaciones clínicas y puede durar hasta veintiún días. |
| Fase de manifestaciones | Día 1-3 | Fiebre, dolor de cabeza, dolores musculares, inflamación de ganglios linfáticos en cuello, axilas o ingle. Puede comenzar a manifestarse salpullido macular (ronchas planas y con cambio de coloración) en la cara, brazos, piernas, palmas de las manos y plantas de los pies. |
| Día 3 | Lesiones en la piel, que evolucionan a pápulas (ronchas con elevación de < 0.5 cm de diámetro). | |
| Día 4-5 | Lesiones en la piel, que evolucionan a vesículas (ronchas elevadas y llenas de fluido claro o amarillento). | |
| Día 6-7 | Lesiones en la piel, que evolucionan a pústulas (ronchas con líquido purulento o turbio). | |
| Día 14-28 | Pústulas, que evolucionan a costras. Las costras se caen con el paso del tiempo y dejan cicatrices. |
En la mayoría de los casos, el salpullido se localiza de manera predominante en la cara, las palmas de las manos, las plantas de los pies y las extremidades, pero también se presenta en mucosa oral, genitales y conjuntiva. El número de erupciones puede ir de unas cuantas hasta miles, y pueden desaparecer en un periodo de dos a cuatro semanas. Entre las complicaciones podemos enlistar infecciones bacterianas secundarias, bronconeumonía, encefalitis, infecciones oculares y deshidratación (Petersen, Abubakar et al., 2019).
Aunque aún se continúa investigando, estudios recientes sugieren que la principal vía de contagio del vvm de humano a humano no es por medio de gotas de fluido provenientes del sistema respiratorio (como en el caso del sars-cov-2 o de la influenza), sino el contacto estrecho con el fluido de las lesiones cutáneas. Sin embargo, se ha sugerido que también podría contagiarse a través de fluidos sexuales, como el semen (Lapa et al., 2022). De cualquier manera, el estrecho contacto corporal implicado en las relaciones sexuales representa un factor importante para que la probabilidad de contagio sea mayor (Tarín-Vicente et al., 2022).
En un estudio realizado en España se observó que el 90% de las personas contagiadas y estudiadas eran hombres que mantenían relaciones sexuales con otros hombres (Tarín-Vicente et al., 2022). En el mismo estudio, la complicación que se presentó con mayor incidencia fue la proctitis, una inflamación en el recubrimiento del recto que puede presentarse con sangrado o dolor rectal y una sensación continua de tener que defecar. Sin embargo, es importante remarcar que esta infección no está acotada a este tipo de relación sexual, sino a cualquiera que implique contacto directo con lesiones cutáneas.
La infección por el vvm es autolimitante, es decir, suele evolucionar hasta resolverse sin tratamiento, puesto que el organismo y sus mecanismos de defensa inmune se encargan de combatir la enfermedad. Esto, por supuesto, se ve influenciado por factores que pueden hacer que el cuadro patológico se curse con mayor o menor intensidad en cada persona, como el grado de exposición al virus, la carga viral, el estado de salud del paciente y si tiene un sistema inmune en condiciones óptimas. La mortalidad se presenta con mayor frecuencia en los grupos de menor edad, es decir, niños y adultos jóvenes, así como en individuos inmunocomprometidos de cualquier edad (Bunge et al., 2022; Petersen, Kantele et al., 2019). Un estimado de la mortalidad inducida por este virus va del 1 al 10% de los casos (Dou et al., 2023).
A menudo la viruela de mono es confundida con la viruela clásica, pero algo distintivo en la infección con vvm es la presencia de hinchazón en los ganglios linfáticos, sobre todo los inguinales (Tarín-Vicente et al., 2022), que ocurre desde el inicio de la enfermedad y ha sido el signo temprano que permite diferenciar al vvm de la viruela clásica (Ježek et al., 1987).
Prevención
Como se mencionó antes, la enfermedad por vvm es una enfermedad autolimitante, es decir, aquellos pacientes que se han contagiado suelen recuperarse sin intervención médica. De cualquier modo, existen reportes de casos graves que requirieron hospitalización y tratamiento para prevenir la letalidad (Adler et al., 2022).
No existe una cura, tratamiento o vacuna específica para la infección por el vvm; sin embargo, los tratamientos y medidas preventivas implementadas han sido similares a aquellas utilizadas en infecciones por otros orthopoxvirus, como la viruela clásica. Los recientes brotes del vvm se han controlado con vacunas para la viruela clásica y antivirales.
Como se mencionó anteriormente, la vacuna contra la viruela clásica funciona contra el vvm por la amplia similitud antigénica entre ambos virus. Actualmente, existen dos tipos de vacunas aprobadas para la viruela clásica, que otorgan alrededor del 85% de protección contra el vvm (Fine et al., 1988). Estas son jynneos (también conocida como imavune, imvanex o mva-bn) y acam2000 (Rizk et al., 2022). La primera está hecha con un virus atenuado sin capacidad de replicación, producida con la cepa viral Ankara-Bavaria Nórdica del virus vaccinia (viruela bovina), la cual fue aprobada para su uso en humanos en 2019.
La vacuna acam2000 también está hecha con el virus vaccinia, pero en este caso se emplea en virus que sí tienen, aunque de manera limitada, la capacidad de replicarse. Por lo mismo, acam2000 produce más efectos adversos posinoculación, entre ellos, eczema vaccinatum, el cual causa un salpullido extenso y diseminado. Esta complicación se ha presentado en personas que cursan con dermatitis atópica, una enfermedad en la que la piel sufre inflamación (Reed et al., 2012). Debido a las posibles complicaciones derivadas de la vacunación con acam2000, se sugiere evitar su uso en individuos inmunocomprometidos, como aquellas personas con el virus de la inmunodeficiencia humana (vih) (Rizk et al., 2022).
La vacunación está indicada para la prevención del vvm en adultos mayores de 18 años identificados con alto riesgo de contagio, como aquellos que hayan tenido contacto estrecho con un caso confirmado o trabajadores de la salud que tengan contacto con pacientes infectados (Petersen, Kabamba et al., 2019).
No se puede optar por una vacunación masiva, como en la reciente pandemia del covid-19, debido a que existe un desabasto de vacunas contra la viruela clásica desde su erradicación, declarada en 1980, ya que dejó de ser indispensable para completar el esquema individual de vacunación. Al dejarse de vacunar contra la viruela clásica, la inmunidad generada por la vacunación a través de los años ha disminuido, lo que también podría explicar la emergencia del vvm.
Tratamiento antiviral
Existen alternativas para el tratamiento del vvm, basadas en fármacos antivirales originalmente diseñados contra el virus de la viruela humana. Tecovirimat y Brincidofovir han demostrado eficacia contra el vvm en modelos animales y se han empleado en casos complicados de infección en humanos.
Tecovirimat es el tratamiento de elección para la viruela humana en adultos y ha demostrado eficacia en ensayos con animales infectados con vvm, al reducir notablemente las complicaciones; sin embargo, se requiere de estudios en humanos para que su uso sea aprobado. Este antiviral evita el último paso de maduración de la partícula viral; por consiguiente, la liberación fuera de la célula infectada se ve interrumpida y así el virus ya no se puede diseminar (Rizk et al., 2022).
Brincidofovir es un antiviral que inhibe la función de la dna polimerasa, con lo que impide el ensamblaje del material genético del virus (Hutson et al., 2021) y, al igual que Tecovirimat, ha sido aprobado en Estados Unidos para el tratamiento de la viruela humana desde 2021 (Rizk et al., 2022); no obstante, se requiere de estudios en humanos para su aceptación en el tratamiento del vvm. Una posible e importante complicación en el tratamiento con Brincidofovir es la elevación de transaminasas hepáticas (Rizk et al., 2022), las cuales son enzimas que, a niveles altos, indican una destrucción celular anormal.
En un estudio observacional realizado en el Reino Unido entre agosto de 2020 y septiembre de 2021 (Adler et al., 2022) se analizó el tratamiento con Brincidofovir o Tecovirimat, administrado en cuatro pacientes adultos con la infección por el vvm, con la finalidad de evitar complicaciones por la infección. El paciente que recibió Tecovirimat tuvo una resolución temprana y sin complicaciones de la enfermedad en comparación con el promedio y se observó que se acortó por diez días su estancia intrahospitalaria, cuando la media es de aproximadamente veinte días.
Por otro lado, los tres pacientes tratados con Brincidofovir tuvieron una elevación de las transaminasas hepáticas, por lo cual se suspendió el tratamiento, así que su eficacia en humanos quedó nuevamente inconclusa.
Es indispensable realizar ensayos clínicos que permitan corroborar lo observado en modelos animales e indagar en antivirales aptos y seguros para el tratamiento del vvm, que eviten complicaciones propias de la enfermedad y permitan la recuperación en menor tiempo.
Perspectivas
La vigilancia epidemiológica es clave para detectar tempranamente mutaciones del virus que le permitan diseminarse más rápido entre individuos, o bien, agravar el curso de la enfermedad. Realizar pruebas a las personas que inicien con síntomas característicos del vvm para así contenerlos y evitar el contagio es la clave para prevenir nuevos brotes.
Aunque existen fármacos que se han mostrado eficaces contra otros orthopoxvirus, el desarrollo de antivirales específicos para el vvm es imprescindible para disminuir la mortalidad y complicaciones causadas por esta enfermedad.
Es importante estar alertas a la epidemiología por el resurgimiento de brotes del vvm, tener en cuenta el contacto con casos probables, así como vigilar la aparición de síntomas y el apropiado aislamiento para evitar contagios y, con ello, el aumento paulatino de casos.
Como se mencionó antes, las vacunas contra la viruela humana han demostrado brindar protección contra el vvm por su similitud viral. Se sabe que hay un notable desabasto de estas vacunas por el cese en su producción en las últimas décadas, por lo que reactivarla junto con su distribución sería una medida de prevención necesaria en países endémicos para evitar la diseminación de este virus desde la raíz.
Referencias
Adler, H., Gould, S., Hine, P., Snell, L. B., Wong, W., Houlihan, C. F., Osborne, J. C., Rampling, T., Beadsworth, M. B., Duncan, C. J., Dunning, J., Fletcher, T. E., Hunter, E. R., Jacobs, M., Khoo, S. H., Newsholme, W., Porter, D., Porter, R. J., Ratcliffe, L., … Hruby, D. E. (2022). Clinical features and management of human monkeypox: a retrospective observational study in the uk. The Lancet. Infectious Diseases, 22(8), 1153-1162. https://doi.org/10.1016/S1473-3099(22)00228-6
Bunge, E. M., Hoet, B., Chen, L., Lienert, F., Weidenthaler, H., Baer, L. R. y Steffen, R. (2022). The changing epidemiology of human monkeypox—A potential threat? A systematic review. plos Neglected Tropical Diseases, 16(2). https://doi.org/10.1371/journal.pntd.0010141
Di Giulio, D. B. y Eckburg, P. B. (2004). Human monkeypox: an emerging zoonosis. The Lancet. Infectious Diseases, 4(1), 15-25. https://doi.org/10.1016/S1473-3099(03)00856-9
Dou, Y.-M., Yuan, H. y Tian, H.-W. (2023). Monkeypox virus: past and present. World Journal of Pediatrics, 19(3), 224-230. https://doi.org/10.1007/s12519-022-00618-1
Fine, P. E. M., Ježek, Z., Grab, B. y Dixon, H. (1988). The Transmission Potential of Monkeypox Virus in Human Populations. International Journal of Epidemiology, 17(3), 643-650. https://doi.org/10.1093/ije/17.3.643
Gong, Q., Wang, C., Chuai, X. y Chiu, S. (2022). Monkeypox virus: a re-emergent threat to humans. Virologica Sinica, 37(4), 477-482. https://doi.org/10.1016/j.virs.2022.07.006
Hutson, C. L., Kondas, A. V., Mauldin, M. R., Doty, J. B., Grossi, I. M., Morgan, C. N., Ostergaard, S. D., Hughes, C. M., Nakazawa, Y., Kling, C., Martin, B. E., Ellison, J. A., Carroll, D. D., Gallardo-Romero, N. F. y Olson, V. A. (2021). Pharmacokinetics and Efficacy of a Potential Smallpox Therapeutic, Brincidofovir, in a Lethal Monkeypox Virus Animal Model. mSphere, 6(1). https://doi.org/10.1128/msphere.00927-20
Ježek, Z., Szczeniowski, M., Paluku, K. M. y Mutombo, M. (1987). Human Monkeypox: Clinical Features of 282 Patients. The Journal of Infectious Diseases, 156(2), 293-298. https://doi.org/10.1093/infdis/156.2.293
Kozlov, M. (2022). How does monkeypox spread? What scientists know. Nature. https://doi.org/10.1038/d41586-022-02178-w
Lapa, D., Carletti, F., Mazzotta, V., Matusali, G., Pinnetti, C., Meschi, S., Gagliardini, R., Colavita, F., Mondi, A., Minosse, C., Scorzolini, L., Cicalini, S., Maffongelli, G., Specchiarello, E., Camici, M., Bettini, A., Baldini, F., Francalancia, M., Mizzoni, K., Garbuglia, A. R., Nicastri, E., Girardi, E., Antinori, A., Vaia, F., Maggi, F. y inmi Monkeypox Study Group (2022). Monkeypox virus isolation from a semen sample collected in the early phase of infection in a patient with prolonged seminal viral shedding. The Lancet. Infectious Diseases. https://doi.org/10.1016/S1473-3099(22)00513-8
Moss, B. (2013). Poxvirus dna Replication. Cold Spring Harbor Perspectives in Biology, 5(9), a010199-a010199. https://doi.org/10.1101/cshperspect.a010199
Petersen, B. W., Kabamba, J., McCollum, A. M., Lushima, R. S., Wemakoy, E. O., Muyembe Tamfum, J. J., Nguete, B., Hughes, C. M., Monroe, B. P. y Reynolds, M. G. (2019). Vaccinating against monkeypox in the Democratic Republic of the Congo. Antiviral Research, 162, 171-177. https://doi.org/10.1016/j.antiviral.2018.11.004
Petersen, E., Abubakar, I., Ihekweazu, C., Heymann, D., Ntoumi, F., Blumberg, L., Asogun, D., Mukonka, V., Lule, S. A., Bates, M., Honeyborne, I., Mfinanga, S., Mwaba, P., Dar, O., Vairo, F., Mukhtar, M., Kock, R., McHugh, T., Ippolito, G. y Zumla, A. (2019). Monkeypox — Enhancing public health preparedness for an emerging lethal human zoonotic epidemic threat in the wake of the smallpox post-eradication era. International Journal of Infectious Diseases, 78, 78-84. https://doi.org/10.1016/j.ijid.2018.11.008
Petersen, E., Kantele, A., Koopmans, M., Asogun, D., Yinka-Ogunleye, A., Ihekweazu, C. y Zumla, A. (2019). Human monkeypox: epidemiologic and clinical characteristics, diagnosis, and prevention. Infectious Disease Clinics of North America, 33(4), 1027-1043. https://doi. org/10.1016/j.idc.2019.03.001
Reed, J. L., Scott, D. E. y Bray, M. (2012). Eczema Vaccinatum. Clinical Infectious Diseases, 54(6), 832-840. https://doi.org/10.1093/cid/cir952
Rizk, J. G., Lippi, G., Henry, B. M., Forthal, D. N. y Rizk, Y. (2022). Prevention and treatment of monkeypox. Drugs, 82(9), 957-963. https://doi.org/10.1007/s40265-022-01742-y
Ryan, K. J., Ahmad, N., Alspaugh, J. A., Pottinger, P., Drew, W. L., Reller, B., Reller, M. E., Steinbrink, J. M., Sterling, C. R., Scott, W. y Vedantam, G. (2022). Sherris & Ryan. Microbiología Médica (K. J. Ryan, ed.; 8ª ed.). McGraw Hill Education.
Secretaría de Salud (18 de mayo de 2023). En últimos 14 días se confirman nueve casos de mpox en México. Gobierno de México. https://www.gob.mx/salud/prensa/105-en-ultimos- 14-dias-se-confirman-nueve-casos-de-mpox-en-mexico
Tarín-Vicente, E. J., Alemany, A., Agud-Dios, M., Ubals, M., Suñer, C., Antón, A., Arando, M., Arroyo-Andrés, J., Calderón-Lozano, L., Casañ, C., Cabrera, J. M., Coll, P., Descalzo, V., Folgueira, M. D., García-Pérez, J. N., Gil-Cruz, E., González-Rodríguez, B., Gutiérrez- Collar, C., Hernández-Rodríguez, Á., López-Rpa, P. y Mitjà, O. (2022). Clinical presentation and virological assessment of confirmed human monkeypox virus cases in Spain: a prospective observational cohort study. Lancet, 400(10353), 661-669. https://doi.org/10.1016/S0140-6736(22)01436-2