Vol. 19, núm. 47, 2023
doi: http://doi.org/inventio/10.30973/2023.19.47/5
La electroquímica como alternativa en el tratamiento de aguas contaminadas con metales pesados
Electrochemistry as an alternative for the treatment of water contaminated with heavy metals
Daysi Elusaí Millán Ocampo
0000-0003-2769-9408, daysi.millanoca@uaem.edu.mx
Investigadora posdoctoral, Centro de Investigación en Ingeniería y Ciencias Aplicadas (ciicap), Universidad Autónoma del Estado de Morelos (uaem)
Arianna Parrales Bahena
0000-0001-8554-8777, arianna.parrales@uaem.mx
Cátedras conahcyt, ciicap, uaem
José Alfredo Hernández Pérez
0000-0002-2107-3044, alfredo@uaem.mx
ciicap, uaem
Shirley Irazoque Castañeda
0000-0002-0046-496X, sic@ier.unam.mx
Investigadora posdoctoral, ciicap, uaem
Susana Silva Martínez
0000-0003-3302-4984, ssilva@uaem.mx
ciicap, uaem
resumen
La contaminación del agua por metales pesados es un problema ambiental de gran preocupación, debido a los efectos perjudiciales que pueden tener en la salud humana y en los ecosistemas acuáticos. Los metales pesados, como el plomo, el cadmio, el mercurio y el cromo, son altamente tóxicos y pueden acumularse en los organismos vivos, causando daños irreparables. Ante esta problemática, es fundamental encontrar soluciones eficientes y sostenibles para eliminar estos contaminantes del agua. En el presente trabajo, haremos una revisión de los métodos electroquímicos más utilizados para tratar aguas contaminadas con metales pesados, y cómo estos ofrecen una solución efectiva y respetuosa con el medio ambiente.
palabras clave
contaminación, residuos tóxicos, electroquímica
abstract
Heavy metal contamination of water is an environmental problem of great concern, due to the detrimental effects it can have on human health and aquatic ecosystems. Heavy metals, such as lead, cadmium, mercury, and chromium, are highly toxic and can accumulate in living organisms, causing irreparable damage. Faced with this problem, it is essential to find efficient and sustainable solutions to eliminate these contaminants from water. In this paper, we will review the most widely used electrochemical methods to treat water contaminated with heavy metals, and how they offer an effective and environmentally friendly solution.
key words
pollution, toxic waste, electrochemistry
Los metales pesados y sus consecuencias ambientales
Los metales pesados son elementos químicos que presentan una alta densidad y resultan tóxicos para los seres vivos, incluso en bajas concentraciones. Algunos ejemplos comunes son el mercurio (Hg), cadmio (Cd), plomo (Pb), cromo (Cr) y cobre (Cu), en orden decreciente de toxicidad (Shrestha et al., 2021). Estos metales se encuentran de forma natural en el medio ambiente, pero su liberación descontrolada por actividades humanas, como la minería, la industria manufacturera, la quema de combustibles fósiles, la industria metalúrgica y el uso de pesticidas y fertilizantes, ha llevado a su acumulación en cuerpos de agua, lo que representa una seria amenaza para la vida acuática y la salud humana (Kong et al., 2011).
Una vez liberados, estos metales pueden persistir en el entorno durante largos periodos y acumularse en los ecosistemas, y pueden ingresar al cuerpo humano a través de la inhalación de partículas en el aire, la ingesta de alimentos y agua contaminados o el contacto directo con materiales que los contienen. A continuación, describiremos algunos metales pesados con mayor relevancia.
Cobre
El cobre tiene una gran importancia comercial, y se sitúa en la tercera posición, detrás del hierro/acero y el aluminio. Sus aplicaciones se enfocan principalmente en aprovechar su excelente conductividad eléctrica y térmica, por ejemplo, en la elaboración de cables y contactos eléctricos, radiadores automovilísticos, intercambiadores de calor, paneles solares, tuberías, válvulas y accesorios de sistemas de agua y otros fluidos acuosos (Al-Saydeh et al., 2017; Khattab et al., 2013; Scott, 2001). Incluso en los seres humanos se considera esencial, pues se ubica en la tercera posición en cuanto a grado de concentración (80-150 mg en adultos) de metales traza, después del hierro y el zinc (Sandstead, 1975; Saloomons, 1985). Sin embargo, en exceso puede generar problemas gastrointestinales y trastornos metabólicos (Shrestha et al., 2021).
Cadmio
El cadmio es considerado como un metal no esencial y uno de los más tóxicos presentes en el medio ambiente. Tiene la capacidad de acumularse en los organismos vivos durante tiempos prolongados y, una vez que se ha ingerido, genera inhibición de la absorción de hierro y zinc en el sistema digestivo, así como daño renal. También puede producir cáncer al ser inhalado (Shrestha et al., 2021). Su uso más importante se da en baterías mezcladas con níquel, que son conocidas por su alto desempeño y bajo mantenimiento (Haider et al., 2021; Sadegh Safarzadeh et al., 2007; Vasudevan y Lakshmi, 2011).
Mercurio
El mercurio es un elemento que podemos encontrar en estado natural formando parte de minerales. Sin embargo, su uso como catalizador en la extracción de metales preciosos, dispositivos electrónicos, pintura, entre otros, ha permitido que su presencia se expanda hacia los ecosistemas acuáticos y terrestres. Al ingerirse provoca problemas gastrointestinales y daño renal, además de tener mayores probabilidades de generar tumores benignos (Driscoll et al., 2013; Shrestha et al., 2021).
Regulaciones y medidas de control
Para evitar la contaminación por metales pesados se han implementado regulaciones y medidas de control en diferentes industrias y sectores. Esto incluye la reducción de emisiones y vertidos industriales, la implementación de prácticas de gestión adecuadas en la minería, el uso seguro y responsable de productos químicos y la vigilancia de los niveles de metales pesados en el agua potable y en los alimentos.
De acuerdo con la normatividad vigente en México, la Norma Oficial Mexicana nom-002-semarnat-1996 establece los límites máximos permisibles de contaminantes que pueden ser descargados a los sistemas de alcantarillado urbano o municipal, los cuales se pueden observar en la tabla 1 (Diario Oficial de la Federación [dof], 2014). En lo que respecta a la potabilización del agua para uso y consumo humano, la nom-127-ssa1-1994 establece los límites permisibles de calidad que se muestran en la tabla 2 (p. 4) (dof, 2000).
Con el fin de cumplir con la normatividad vigente, es necesario implementar métodos de tratamiento de los efluentes contaminados con metales pesados provenientes de las industrias mencionadas anteriormente. Una de las alternativas es, precisamente, la aplicación de métodos electroquímicos, tal como lo describiremos a continuación.
Tabla 1
Límites máximos permisibles para contaminantes en aguas residuales
| Parámetros (mg L-1) | Promedio mensual | Promedio diario | Instantáneo |
|---|---|---|---|
| Grasas y aceites | 50 | 75 | 100 |
| Sólidos sedimentables (mL L-1) | 5 | 7.5 | 10 |
| Arsénico total | 0.5 | 0.75 | 1 |
| Cadmio total | 0.5 | 0.75 | 1 |
| Cianuro total | 1 | 1.5 | 2 |
| Cobre total | 10 | 15 | 20 |
| Cromo total | 0.5 | 0.75 | 1 |
| Mercurio total | 0.01 | 0.015 | 0.02 |
| Níquel total | 4 | 6 | 8 |
| Plomo total | 1 | 1.5 | 2 |
| Zinc total | 6 | 9 | 12 |
Fuente: dof, 2014.
Tabla 2
Límites permisibles de calidad para la potabilización del agua
| Característica | Límite máximo permisible (mg L-1) |
|---|---|
| Arsénico | 0.05 |
| Cadmio | 0.005 |
| Cobre | 2.00 |
| Cromo | 0.05 |
| Hierro | 0.30 |
| Mercurio | 0.001 |
| Plomo | 0.01 |
| Zinc | 5.00 |
Fuente: dof, 2000.
Potencial de la electroquímica en el tratamiento de aguas contaminadas
La electroquímica es una disciplina científica que estudia las interacciones entre la electricidad y las reacciones químicas. En el contexto del tratamiento de aguas contaminadas, ofrece varias ventajas significativas. Los métodos electroquímicos son procesos ambientalmente amigables, ya que no requieren el uso de productos químicos adicionales para eliminar los metales pesados y son altamente eficientes y selectivos. Existen varias técnicas electroquímicas que se utilizan para el tratamiento de metales pesados. Entre las más destacadas se encuentran la electroflotación, electrodiálisis, electrocoagulación y electrodeposición.
Electroflotación
En esta técnica, la corriente eléctrica se utiliza para generar burbujas de gas (hidrógeno) en el electrodo sumergido en el agua contaminada. Estas burbujas se adhieren a los contaminantes metálicos y forman flóculos que ascienden a la superficie del agua, donde se pueden retirar fácilmente mediante filtración (figura 1a). Este método es especialmente eficaz para el tratamiento de aguas con partículas finas, coloides y concentraciones moderadas de metales pesados (Azimi et al., 2017; Carolin et al., 2017; Maarof et al., 2017; Qasem et al., 2021).
Este proceso se basa en la aplicación de una diferencia de potencial eléctrico, a través de una membrana selectiva de iones que divide el agua contaminada en dos compartimentos. Los iones metálicos migran a través de la membrana de intercambio iónico catiónico hacia el compartimento opuesto, debido a la atracción o repulsión eléctrica. Esto permite separar y concentrar los metales pesados (cationes +) en el compartimento donde se encuentra el cátodo (-), mientras que el agua tratada se recoge en el otro extremo (figura 1b). Se utiliza cuando los metales están presentes en forma de iones y se requiere su separación selectiva (Al-Saydeh et al., 2017; Barakat, 2011; Carolin et al., 2017, Qasem et al., 2021; Shrestha et al., 2021).
Figura 1
Esquemas generales de técnicas electroquímicas aplicables al tratamiento de aguas contaminadas con metales pesados
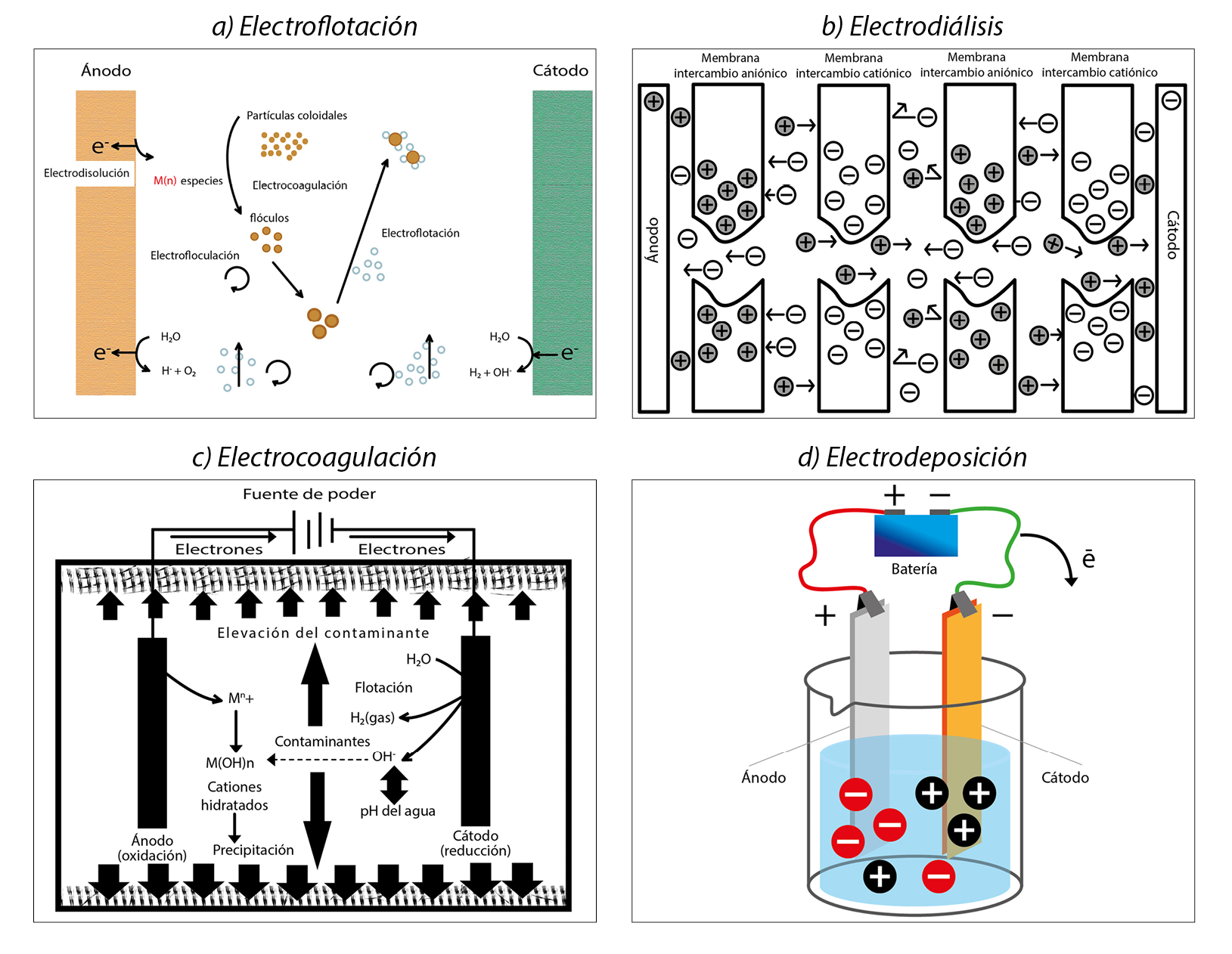
Fuente: Holt et al., 2002; Prieto García et al., 2014; Sacarazzato et al., 2017.
Electrocoagulación
Esta técnica recurre a la aplicación de corriente eléctrica para generar coagulantes in situ. Los contaminantes suspendidos o emulsionados se neutralizan y luego se coagularán a partir de la fase acuosa. Las partículas de metales pesados se unen como pequeños imanes para formar una masa que se denomina lodo o flóculo, lo que facilita la separación del agua mediante un proceso adicional, como la filtración (figura 1c). Este método es altamente eficiente para la eliminación de una amplia gama de metales pesados en concentraciones relativamente altas y puede funcionar en un amplio rango de pH (Azimi et al., 2017; Maarof et al., 2017).
Electrodeposición
Para llevar a cabo la electrodeposición de metales pesados en aguas contaminadas, se utiliza una celda electrolítica que consta de dos electrodos: un ánodo y un cátodo. Al suministrar energía eléctrica a la celda se desarrollan los procesos de oxidación (ánodo) y reducción (cátodo), y se consigue que los iones metálicos presentes en el efluente se depositen sobre la superficie del cátodo. Esta técnica es efectiva incluso para bajas concentraciones de metales y puede funcionar en un amplio rango de pH (figura 1d) (Azimi et al., 2017; Caroline et al., 2017; Higgs et al., 2022; Maarof et al., 2017; Qasem et al., 2021).
Este tipo de procesos se pueden desarrollar de manera potenciostática, es decir, aplicando un voltaje fijo, o de forma galvanostática, esto es, aplicando una corriente fija y altas eficiencias de remoción. En principio, cualquier material conductor puede ser usado como electrodo; sin embargo, la selección del material se da en función del tipo de metal que se desee recuperar.
En la tabla 3 podemos observar algunos trabajos reportados en la literatura, enfocados en el tratamiento de efluentes contaminados con metales pesados mediante métodos electroquímicos y convencionales. De acuerdo con esta comparativa, los primeros generan eficiencias de remoción que van desde 60% a 99%, mientras que el tratamiento mediante precipitación química presenta porcentajes más bajos, de alrededor de 30%.
Tabla 3
Trabajos reportados para el tratamiento de metales pesados mediante métodos electroquímicos y convencionales
| Referencia | Método electroquímico | Metales pesados | Tiempo de proceso | Material del electrodo/Reactivo químico | Eficiencia de remoción (%) |
|---|---|---|---|---|---|
| Ciszewski et al., 2022. | Electrodeposición | Pb (II) | 2 h | Acero | 82 |
| Kuleyin y Uysal, 2020. | Electrodeposición | Cu (II) | 1 h | Cobre y acero inoxidable | 66, 80 |
| Ano et al., 2023. | Electrocoagulación | Pb (II) Cu (II) |
1 h | Hierro | 95.15 80.22 |
| Vargas et al., 2023. | Electrocoagulación | Ni (II) | 1.5 h | Aluminio | 97.8 |
| Merzouk et al., 2009. | Electroflotación | Fe (II) Pb (II) Ni (II) Cu (II) |
5-15 min | Aluminio | 93-99 |
| Ali et al., 2023. | Electroflotación | Fe (II) Zn (II) Co (II) Cu (II) Ni (II) |
30 min | Acero inoxidable | 95-99 |
| Arana Juve et al., 2022. | Electrodiálisis | Pb (II) | 1 h | Platino | 99 |
| Yi et al., 2022. | Electrodiálisis | Mn (II) Cr (II) Cd (II) Pb (II) |
2 h | Carbón | 87-97 |
| Ozverdi y Erdem, 2006. | Precipitación química | Cd (II) Pb (II) Cu (II) |
2 h | Pirita | 34.2, 94.2, 45.2 |
| Ozverdi y Erdem, 2006. | Precipitación química | Cd (II) Pb (II) Cu (II) |
2 h | Sulfuro de hierro | 68.5-99.8 |
| Yu et al., 2000. | Adsorción | Cu (II) | 24 h | Aserrín | 58.6-94.8 |
| Hu et al., 2009. | Adsorción | Cr (VI) | 165 h | mwcnt oxidado | 50-100 |
Fuente: Elaboración propia.
En cuanto a tiempos de proceso son similares, a excepción del método por adsorción, que requiere largos periodos para alcanzar el equilibrio, en lo que se han registrado tiempos de hasta 165 h, mientras en el proceso de electroflotación los periodos son muy cortos, incluso entre 5 y 15 minutos.
La selección de la técnica electroquímica adecuada para tratar aguas contaminadas con metales pesados depende de varios factores, como la naturaleza de los metales presentes, las concentraciones, el pH del agua, la disponibilidad de energía y los requisitos específicos del tratamiento. En algunos casos, puede ser necesario combinar diferentes técnicas o utilizar pretratamientos para optimizar la eficiencia del proceso. Además, es recomendable consultar a expertos en el campo de la electroquímica y la gestión del agua para obtener una recomendación específica para cada caso.
En la figura 2 se muestra un ejemplo de tren de tratamiento aplicable a efluentes provenientes de procesos de galvanoplastia. En la primer etapa del tratamiento se aplica electrodiálisis, con el fin de concentrar los iones cobre presentes en el efluente. Posteriormente, se implementa la electrodeposición, donde se obtiene el metal en estado puro mediante depósitos en el cátodo, lo que brinda la posibilidad de reutilizar este metal e incluso comercializarlo. Finalmente, se aplica precipitación química para recuperar el resto de los metales, como el hierro (Fe), cromo (Cr), níquel (Ni) y zinc (Zn) (Kim et al., 2022).
Figura 2
Tren de tratamiento para efluente proveniente de industria de galvanoplastia
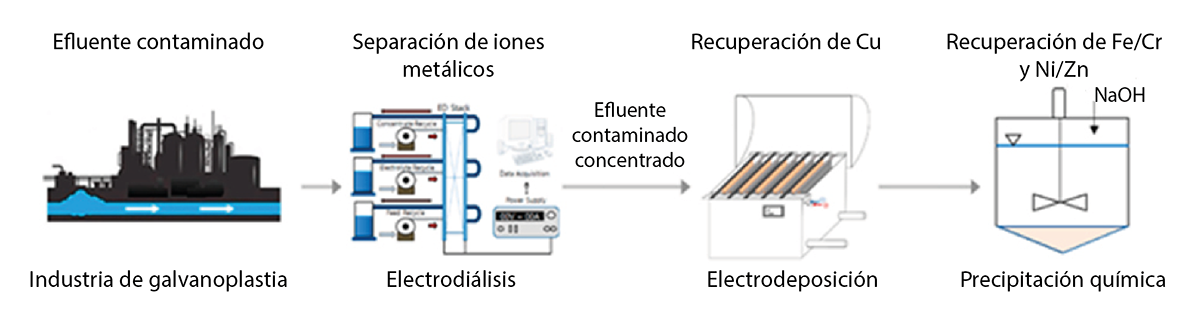
Fuente: Kim et al., 2002.
Cada uno de los tratamientos antes mencionados ofrecen ventajas y desventajas particulares. En la tabla 4 (p. 8) se resumen algunas de ellas para su comparativa. Los métodos electroquímicos, por su parte, ofrecen una solución que reduce el impacto ambiental con respecto a los métodos convencionales. Sin embargo, la mayor desventaja que presentan se centra en los altos consumos de energía. Por ello, se han desarrollado múltiples modificaciones en la superficie de los materiales con el propósito de potencializar sus propiedades de conductividad e incrementar el área superficial, principalmente, con lo que se ha conseguido mejorar su desempeño en la remoción de metales pesados y disminuir el consumo energético. A su vez, se podría considerar el uso de energías limpias que puedan reducir el costo asociado a este aspecto.
Tabla 4
Metodologías de tratamiento aplicables en la remoción de metales pesados
| Tipo de tratamiento | Método de tratamiento | Ventajas | Desventajas | Referencias |
|---|---|---|---|---|
| Electroquímico | Electrocoagulación | Operatividad sencilla al generar coagulante in situ. Uso de reactivos “limpios” (electrones). Reducción de costos asociados a reactivos químicos. Menor cantidad de lodos residuales y flóculos más estables. Las burbujas generadas durante la electrólisis permiten separar el contaminante de forma sencilla. El sistema requerido es compacto y altamente eficiente. |
Alto consumo de energía eléctrica. Requiere un tratamiento complementario para separar el hidróxido metálico, como filtración o sedimentación. Es necesario usar un electrolito altamente conductivo. Ocasionalmente, el ánodo requiere reemplazo. La pasivación del ánodo representa un desperdicio energético. |
Azimi et al., 2017; Maarof et al., 2017. |
| Electroquímico | Electrodeposición | No requiere uso de reactivos químicos. No genera lodos residuales. Altas eficiencias de remoción. Posee una alta selectividad. Bajos costos de operación. Potencial para recuperar el metal en su estado puro. |
Requiere personal especializado para crear un diseño de celda adecuado y optimizar los parámetros de operación. La generación de hidrógeno y reducción de oxígeno pueden disminuir la eficiencia. |
Azimi et al., 2017; Caroline et al., 2017; Maarof et al., 2017; Qasem et al., 2021. |
| Electroquímico | Electroflotación | Altas eficiencias de remoción. Tiempos de proceso muy cortos. Adaptabilidad. Practicidad en cuanto a diseño y operatividad. Unidades de tamaño compacto. |
Alto consumo de energía eléctrica. Requiere un pretratamiento de electrocoagulación y un tratamiento complementario para separar el contaminante, como filtración o sedimentación. Bajas eficiencias de remoción en concentraciones diluidas. |
|
| Electroquímico | Electrodiálisis | Bajo consumo de productos químicos. Altos porcentajes de remoción. |
Obstrucción y descamación de la membrana. Baja selectividad. Alto consumo de energía. Existen probabilidades de precipitación metálica. |
Carolin et al., 2017; Qasem et al., 2021; Shrestha et al., 2021. |
| Fisicoquímico | Precipitación química | Fácil operatividad y automatización. Forma precipitados de “fácil” remoción mediante tratamientos adicionales. |
Requiere demasiados reactivos químicos. Genera contaminantes secundarios tóxicos que requieren tratamiento. Requiere tratamientos complementarios, como filtración o sedimentación. No es apto para remover todo tipo de metales pesados y posee bajas eficiencias de remoción. Tiempos de proceso largos. Genera demasiados lodos residuales. |
Azimi et al., 2017; Zamora Ledezma et al., 2021. |
| Fisicoquímico | Adsorción | Alta capacidad de adsorción. Los adsorbentes pueden regenerarse. El material adsorbente puede provenir de residuos de industria, agricultura o ser de origen natural. |
Tiempos de proceso muy extensos para alcanzar el equilibrio. Únicamente funciona en intervalos de pH limitados. Baja selectividad. Produce contaminantes secundarios. La aglomeración de nanomateriales adsorbentes disminuye su efectividad. |
Azimi et al., 2017; Shrestha et al., 2021; Zhu et al., 2019. |
| Fisicoquímico | Coagulación-floculación | Procesos de operación simples y relativamente económicos. | Bajas eficiencias de remoción. Altos costos asociados a reactivos químicos. Generación de contaminantes secundarios. |
Carolin et al., 2017; Zamora Ledezma et al., 2021. |
Fuente: Elaboración propia.
En cuanto a costos, desafortunadamente en la literatura rara vez se reporta este aspecto. Esto se debe a que resulta complicado comparar métodos de manera cuantitativa, pues los costos de proceso se encuentran en función de múltiples aspectos, como equipos, características del efluente a tratar, concentraciones y tipo de metal, consumo energético, calidad requerida del efluente tratado, entre otros (Kurniawan et al., 2006) En términos generales, los procesos electroquímicos reducen costos asociados al uso de reactivos químicos durante el tratamiento.
Además, al generar una mínima o nula cantidad de contaminantes secundarios se elimina el costo que implica la disposición/tratamiento de lodos, lo que, en casos particulares, resulta equiparable con los métodos tradicionales, pues el consumo de energía eléctrica con métodos electroquímicos suele ser alto. Pero en otros casos, a pesar del consumo energético requerido, se logra generar menores costos de proceso. Ejemplo de ello es el trabajo desarrollado por Meunier et al. (2006), donde se muestra un análisis comparativo entre electrocoagulación y precipitación química, en el que se encuentra que el método electroquímico es cinco veces más económico que el método fisicoquímico.
Conclusiones
Sin duda, la electroquímica resulta clave en el desarrollo de nuevas metodologías para la remediación de aguas residuales, pues brinda múltiples ventajas, incluyendo alta eficiencia de eliminación, versatilidad, baja/nula generación de residuos, y no requiere adición de reactivos químicos. Estas ventajas hacen que la electroquímica sea una opción atractiva para abordar problemas de contaminación del agua por metales pesados. A su vez, disminuye considerablemente los costos asociados al tratamiento de residuos y el uso de reactivos químicos, pues día con día se trabaja en el desarrollo de nuevos y mejores materiales que optimicen los tiempos de proceso y el consumo energético, lo que contribuye a la conservación del medio ambiente y la salud pública, pues el riesgo de estos contaminantes es muy alto.
Finalmente, es importante mencionar que, debido a los altos niveles de contaminación, el tratamiento de efluentes no es suficiente y está en nuestras manos colaborar activamente. Esto se puede lograr mediante el consumo responsable de productos que poseen estos contaminantes y, de ser posible, con la limitación de su uso.
Referencias
Al-Saydeh, S. A., El-Naas, M. H. y Zaidi, S. J. (2017). Copper removal from industrial wastewater: a comprehensive review. Journal of Industrial and Engineering Chemistry, 56, 35-44. https://doi.org/10.1016/j.jiec.2017.07.026
Ali, I., Alyona, S., Tatiana, K., Anastasiya, G., Albishri, H. M. y Alshitari, W. H. (2023). Facile adsorption-electroflotation method for the removal of heavy metal ions from water using carbon nanomaterials. Environmental Science and Pollution Research, 30, 38970-38981. https://doi.org/10.1007/s11356-022-24509-0
Ano, J., Koné, H., Yapo, N. S., Drogui, P., Yao, K. y Adouby, K. (2023). Removal of copper and lead by electrocoagulation process: effects of experimental parameters and optimization with full factorial designs. J. Mater. Environ. Sci, 14(2), 173-183. https://www.jmaterenvironsci.com/Document/vol14/vol14_N2/JMES-2023-14013-Ano.pdf
Arana Juve, J. M., Christensen, F. M. S., Wang, Y. y Wei, Z. (2022). Electrodialysis for metal removal and recovery: A review. Chemical Engineering Journal, 435, 1-20. https://doi.org/10.1016/j.cej.2022.134857
Azimi, A., Azari, A., Rezakazemi, M. y Ansarpour, M. (2017). Removal of Heavy Metals from Industrial Wastewaters: A Review. ChemBioEng Reviews, 4(1), 37-59. https://doi.org/10.1002/cben.201600010
Barakat, M. A. (2011). New trends in removing heavy metals from industrial wastewater. Arabian Journal of Chemistry, 4, 361-377. https://doi.org/10.1016/j.arabjc.2010.07.019
Carolin, C. F., Kumar, P. S., Saravanan, A., Joshiba, G. J. y Naushad, M. (2017). Efficient techniques for the removal of toxic heavy metals from aquatic environment: A review. Journal of Environmental Chemical Engineering, 5(3), 2782-2799. https://doi.org/10.1016/j.jece.2017.05.029
Ciszewski, M., Drzazga, M., Kowalik, P., Orda, S. y Hawełek, Ł. (2022). Lead electrodeposition from aliphatic polyamines solutions. sn Applied Sciences, 4(4). https://doi.org/10.1007/s42452-022-05020-0
Diario Oficial de la Federación (2000). nom-127-ssa1-1994: Salud ambiental. Agua para uso y consumo humano. Límites permisibles de calidad y tratamientos a los quedebe someterse el agua para su potabilización. Diario Oficial de la Federación, 73178. https://dof.gob.mx/nota_detalle.php?codigo=4866379&fecha=18/01/1996
Diario Oficial de la Federación (2014). nom-002-semarnat-1996: Límites máximos permisibles de contaminantes en las descargas de aguas residuales en aguas y bienes nacionales. Diario Oficial de la Federación, 1-66. https://dof.gob.mx/nota_detalle.php?codigo=4881304&fecha=03/06/1998#gsc.tab=0
Driscoll, C. T., Mason, R. P., Chan, H. M., Jacob, D. J. y Pirrone, N. (2013). Mercury as a global pollutant: Sources, Pathways, and Effects. Environmental Science and Technology, 47(10), 4967-4983. https://doi.org/10.1021/es305071v
Haider, F. U., Liqun, C., Coulter, J. A., Cheema, S. A., Wu, J., Zhang, R., Wenjun, M. y Farooq, M. (2021). Cadmium toxicity in plants: Impacts and remediation strategies. Ecotoxicology and Environmental Safety, 211, 1-22. https://doi.org/10.1016/j.ecoenv.2020.111887
Higgs, J. M., Bingham, B. R. y Boyer, R. (2022). Alternating Current for the Selective Electrodeposition of Cadmium, Iron, and Chromium Method Development for Simulated Industrial Wastewater Sludge. International Journal of Water and Wastewater Treatment, 8(1), 1-5. https://doi.org/10.16966/2381-5299.182
Holt, P. K., Barton, G. W., Wark, M. y Mitchell, C. A. (2002). A quantitative comparison between chemical dosing and electrocoagulation. Colloids and Surfaces, 211, 233-248. https://doi.org/10.1016/S0927-7757(02)00285-6
Hu, J., Chen, C., Zhu, X. y Wang, X. (2009). Removal of chromium from aqueous solution by using oxidized multiwalled carbon nanotubes. Journal of Hazardous Materials, 162(2-3), 1542-1550. https://doi.org/10.1016/j.jhazmat.2008.06.058
Khattab, I. A., Shaffei, M. F., Shaaban, N. A., Hussein, H. S. y Abd El-Rehim, S. S. (2013). Electrochemical removal of copper ions from dilute solutions using packed bed electrode. Part ii. Egyptian Journal of Petroleum, 22(1), 205-210. https://doi.org/10.1016/j.ejpe.2012.09.012
Kim, J., Yoon, S., Choi, M., Min, K. J., Park, K. Y., Chon, K. y Bae, S. (2022). Metal ion recovery from electrodialysis-concentrated plating wastewater via pilot-scale sequential electrowinning/chemical precipitation. Journal of Cleaner Production, 330, 1-9. https://doi.org/10.1016/j.jclepro.2021.129879
Kong, Y., Wei, J., Wang, Z., Sun, T., Yao, C. y Chen, Z. (2011). Heavy metals removal from solution by polyaniline/palygorskite composite. Journal of Applied Polymer Science, 122(3), 2054-2059. https://doi.org/10.1002/app.34195
Kuleyin, A. y Uysal, H. E. (2020). Recovery of copper ions from industrial wastewater by electrodeposition. International Journal of Electrochemical Science, 15(2), 1474-1485. https://doi.org/10.20964/2020.02.39
Kurniawan, T. A., Chan, G. Y. S., Lo, W. H. y Babel, S. (2006). Physico-chemical treatment techniques for wastewater laden with heavy metals. Chemical Engineering Journal, 118(1-2), 83-98. https://doi.org/10.1016/j.cej.2006.01.015
Maarof, H. I., Daud, W. M. A. W. y Aroua, M. K. D. (2017). Recent trends in removal and recovery of heavy metals from wastewater by electrochemical technologies. Reviews in Chemical Engineering, 33, 359-386. https://doi.org/10.1515/revce-2016-0021
Merzouk, B., Gourich, B., Sekki, A., Madani, K. y Chibane, M. (2009). Removal turbidity and separation of heavy metals using electrocoagulation-electroflotation technique. A case study. Journal of Hazardous Materials, 164(1), 215-222. https://doi.org/10.1016/j.jhazmat.2008.07.144
Meunier, N., Drogui, P., Montané, C., Hausler, R., Mercier, G. y Blais, J. F. (2006). Comparison between electrocoagulation and chemical precipitation for metals removal from acidic soil leachate. Journal of Hazardous Materials, 137(1), 581-590. https://doi.org/10.1016/j.jhazmat.2006.02.050
Özverdi, A. y Erdem, M. (2006). Cu2+, Cd2+ and Pb2+ adsorption from aqueous solutions by pyrite and synthetic iron sulphide. Journal of Hazardous Materials, 137, 626-632. https://doi.org/10.1016/j.jhazmat.2006.02.051
Prieto-García, F., Callejas-Hernández, J., Reyes-Cruz, V. E., Marmolejo-Santillán, Y. y Prieto-Méndez, J. (2014). Electrodissolution aluminum electrode during an electrocoagulation acid whey. dyna (Colombia), 81(187), 129-136. https://doi.org/10.15446/dyna.v81n187.40757
Qasem, N. A. A., Mohammed, R. H. y Lawal, D. U. (2021). Removal of heavy metal ions from wastewater: a comprehensive and critical review. Clean Water, 4(1), 1-15. https://doi.org/10.1038/s41545-021-00127-0
Sadegh Safarzadeh, M., Bafghi, M. S., Moradkhani, D.y y Ojaghi Ilkhchi, M. (2007). A review on hydrometallurgical extraction and recovery of cadmium from various resources. Minerals Engineering, 20(3), 211-220. https://doi.org/10.1016/j.mineng.2006.07.001
Sandstead, H. (1975). Some trace elements which are essential for human nutrition. Progress in Food and Nutrition Science, 1, 371-391.
Scarazzato, T., Panossian, Z., Tenório, J. A. S., Pérez-Herranz, V. y Espinosa, D. C. R. (2017). A review of cleaner production in electroplating industries using electrodialysis. Journal of Cleaner Production, 168, 1590-1602. https://doi.org/10.1016/j.jclepro.2017.03.152
Scott, W. W. (2001). asm Specialty Handbook ® Copper and Copper Alloys (Davis & Associates [ed.]; 1st ed.). asm International. http://www.asminternational.org
Shrestha, R., Ban, S., Devkota, S., Sharma, S., Joshi, R., Tiwari, A. P., Kim, H. Y. y Joshi, M. K. (2021). Technological trends in heavy metals removal from industrial wastewater: A review. Journal of Environmental Chemical Engineering, 9(4), 2213-3437. https://doi.org/10.1016/j.jece.2021.105688
Solomons, N. W. (1985). Biochemical, Metabolic, and Clinical Role of Copper in Human Nutrition. Journal of the American College of Nutrition, 4(1), 83-105. https://doi.org/10.1080/07315724.1985.10720069
Vargas, A. R., Guillén, C. S., Magaña Haynes, M. E. y AlJaberi, F. Y. (2023). Nickel removal from an industrial effluent by electrocoagulation in semi-continuous operation: Hydrodynamic, kinetic and cost analysis. Results in Engineering, 17, 1-14. https://doi.org/10.1016/j.rineng.2023.100961
Vasudevan, S. y Lakshmi, J. (2011). Effect of alternating and direct current in an electrocoagulation process on the removal of cadmium from water. Separation and Purification Technology, 80, 643-651. https://doi.org/10.2166/wst.2012.859
Yi, Y., Feng, H., Wang, J., Tang, J., Wu, Y., Liang, X., Guo, Y. y Tang, L. (2022). Simultaneous Recovery of nh3-n and Removal of Heavy Metals from Manganese Residue Leachate Using an Electrodialysis System. acs es and t Water, 3, 793-803. https://doi.org/10.1021/acsestwater.2c00580
Yu, B., Zhang, Y., Shukla, A., Shukla, S. S., & Dorris, K. L. (2000). The removal of heavy metal from aqueous solutions by sawdust adsorption-removal of copper. Journal of Hazardous Materials, 80. https://doi.org/10.1016/S0304-3894(00)00278-8
Zamora-Ledezma, C., Negrete-Bolagay, D., Figueroa, F., Zamora-Ledezma, E., Ni, M., Alexis, F. y Guerrero, V. H. (2021). Heavy metal water pollution: A fresh look about hazards, novel and conventional remediation methods. Environmental Technology and Innovation, 22, 101504. https://doi.org/10.1016/j.eti.2021.101504
Zhu, Y., Fan, W., Zhou, T. y Li, X. (2019). Removal of chelated heavy metals from aqueous solution: A review of current methods and mechanisms. Science of the Total Environment, 678, 253-266. https://doi.org/10.1016/j.scitotenv.2019.04.416