Vol. 19, núm. 47, 2023
doi: http://doi.org/inventio/10.30973/2023.19.47/1
Ecología evolutiva de la resistencia a insecticidas en el mosquito Aedes (stegomyia) aegypti
Evolutionary ecology of insecticide resistance in Aedes (stegomyia) aegypti
Miguel Moreno García
orcid: 0000-0001-6733-9007/miguelmoga2000@yahoo.com.mx
Centro Regional de Control de Vectores “Panchimalco”, Servicios de Salud de Morelos (ssm)
Cassandra González Acosta
orcid: 0000-0003-2682-908X/cgonzalez_vectores@hotmail.com
Servicios de Salud de Morelos (ssm)
Héctor Barón Olivares
hector.baron@ssm.gob.mx
Servicios de Salud de Morelos (ssm)
Fabián Correa Morales
orcid: 0000-0002-6193-1242/fabiancorrea@msn.com
Centro Nacional de Programas Preventivos y Control de Enfermedades (cenaprece), Secretaría de Salud (ssa)
resumen
El mosquito Aedes (stegomyia) aegypti (Linnaeus, 1762), principal vector de los virus del dengue, Zika y chikungunya, está aclimatado a zonas urbanas y su distribución sigue en aumento. Una de las herramientas para su control es el uso de insecticidas; sin embargo, algunas poblaciones se han vuelto resistentes a esos productos. La resistencia es una adaptación del mosquito que le permite lidiar con la presión impuesta por los insecticidas. No obstante, también puede tener costos ecológicos, al afectar otras características e inducir un lento desarrollo, reducción en la longevidad, disminución en la producción y eclosión de huevos. También puede afectar la interacción patógeno-insecto, lo que ocasiona un posible impacto negativo mayor en la salud humana.
palabras clave
enfermedades infecciosas, control, insecticidas, mosquitos, resistencia, salud pública
abstract
The Aedes (stegomyia) aegypti (Linnaeus, 1762) mosquito, the main vector of dengue, Zika and chikungunya viruses, is acclimated to urban areas and its distribution continues to increase. One of the tools for its control is the use of insecticides; however, some populations have become resistant to these products. Resistance is an adaptation of the mosquito that allows it to cope with the pressure imposed by insecticides. Nevertheless, it can also have ecological costs by affecting other characteristics and inducing slow development, reduced longevity, decreased egg production and hatching. It can also affect the pathogen-insect interaction, leading to a possible major negative impact on human health.
key words
infectious diseases, control, insecticides, mosquitoes, resistance, public health
Introducción
Estimaciones de la Organización Mundial de la Salud (oms) indican que los patógenos causantes de enfermedades como el dengue, zika, chikungunya, malaria (paludismo), chagas (tripanosomiasis americana) y rickettsiosis (fiebre de las montañas), transmitidos por mosquitos, chinches, garrapatas, pulgas y piojos, representan más del 17% de todas las enfermedades transmitidas por artrópodos vectores (etv) (Organización Mundial de la Salud [oms], 2017). Cerca de mil millones de casos y un millón de muertes en todo el mundo se deben a las etv (oms, 2020). Brotes de estas enfermedades son los que, en años recientes, han puesto en alerta a los responsables de los programas de salud de varios países, lo cual ha generado una gran inversión para su prevención, control y tratamiento.
En México, la principal etv es la fiebre por dengue, seguida por epidemias esporádicas de fibre del Zika y chikungunya. El mosquito Aedes (Stegomyia) aegypti (Linnaeus, 1762) es el principal vector de los virus causantes de estas etv. La capacidad de diapausa de sus huevos (interrupción del desarrollo embrionario sin perder viabilidad por meses), aclimatación en zonas urbanas, rápido ciclo de vida y preferencia de la hembra por oviponer en cuerpos de agua artificiales, son factores que favorecen la expansión y distribución de este vector (Metz et al., 2023). La migración, el crecimiento desmedido y no planeado de la mancha urbana con asentamientos sin condiciones sanitarias adecuadas y probablemente el cambio climático global, han contribuido igualmente a ello (Ding et al., 2018). En consecuencia, las etv han ampliado su presencia y afectado áreas en las que antes no se reportaba ninguna de estas enfermedades.
Los mosquitos vectores difícilmente podrán ser erradicados; sin embargo, se puede reducir el contacto humano-vector con actividades de prevención y control (Fondo de las Naciones Unidas para la Infancia [unicef], 2016). Entre éstas se encuentran las estrategias de comunicación social para brindar información respecto a la protección personal, la promoción del uso de repelentes y ropa con manga o pantalón largo, así como la colocación de mosquiteros en puertas y ventanas (Centers for Disease Control and Prevention [cdc], 2020). También se cuenta con el control físico y químico, que involucra actividades de saneamiento y uso de insecticidas para reducir la presencia del mosquito.
Si bien el control químico es muy efectivo, su uso indiscriminado ha ocasionado que algunas poblaciones de mosquitos de México (Kuri-Morales et al., 2017) y alrededor del mundo se vuelvan resistentes a los compuestos químicos y se reduzca la mortalidad más de lo esperado (Deming et al., 2016). Esto tiene consecuencia negativas para las poblaciones humanas; sin embargo, la resistencia es una adaptación del mosquito que le permite lidiar con la presión impuesta por los insecticidas y su expresión depende de varios factores. En este trabajo se describe la resistencia a insecticidas, cómo se ve afectada por el entorno ecológico y su posible efecto en la transmisión de patógenos hacia los humanos.
Figura 1
Control químico de Aedes aegypti durante la fase acuática (larva) y la fase adulta

Fuente: Elaboración propia.
Aedes aegypti y su control
Le especie pasa por una fase acuática y una terrestre. La primera inicia por los huevos que la hembra pone en huecos de árboles, charcos temporales, tambos y piletas o en cualquier recipiente que pueda almacenar agua y por lo cual se convierte en un criadero potencial (Clements, 1992). De los huevos emergen las larvas, que pasan por cuatro mudas hasta transformarse en pupas, de donde emergerán los mosquitos (Clements, 1992). En esta fase terrestre, el mosquito buscará apareamiento, alimentación, refugio, y las hembras, un sitio de oviposición dentro o fuera de las viviendas. Sólo pica el mosquito hembra para alimentarse de sangre y producir huevos (Muktar 2016).
Control físico
El saneamiento de los patios y techos de las casas se realiza eliminando llantas, electrodomésticos, botes, cubetas, botellas o cualquier objeto que pueda almacenar agua y sirva de criadero de larvas. En caso de que estos objetos no se puedan desechar deberán taparse para evitar que el mosquito acceda al agua almacenada y coloque huevos (Rodríguez-Cruz, 2002).
Control químico
En los potenciales criaderos donde podrían detectarse larvas se aplican los insecticidas de forma manual con goteros o cucharas dosificadoras (figura 1). Para el control químico de adultos, los productos son aplicados con equipos motorizados (térmicos o en frío) (Centro Nacional de Prevención y Control de Enfermedades [cenaprece], 2020a). También puede aplicarse insecticida con actividad prolongada mediante el rociado de paredes, que es donde los mosquitos suelen reposar (cenaprece, 2020b).
Los insecticidas que más han sido utilizados son de origen sintético, pertenecientes a los grupos de organoclorados, organofosforados, carbamatos y piretroides. Fue en los años ochenta del siglo pasado cuando el uso de estos productos se realizó de manera intensiva, y comúnmente un sólo tipo de insecticida se aplicaba por mucho tiempo; sin embargo, a finales de los años noventa se observó a nivel mundial que ciertas poblaciones de mosquitos (en fases acuática y terrestre) se volvieron resistentes a varios de estos insecticidas (Webb Jr., 2016; oms, 2012). Actualmente, la resistencia sigue siendo algo común.
Resistencia a insecticidas
La resistencia es la habilidad de un organismo para sobrevivir a la exposición de un insecticida, a través de características conductuales, estructurales, fisiológicas, metabólicas o por la modificación proteínas (oms, 1975). La aparición de resistencia se debe a un proceso evolutivo (entre generaciones), dado por selección natural, ocasionado por el uso prolongado de un insecticida (oms, 1975).
Conductualmente, el mosquito puede evitar las zonas donde perciba el olor o irritación causada por el insecticida, lo que provoca que el mosquito busque otra zona de descanso o alimentación (Chareonviriyaphap et al., 2013). Se ha observado que algunos organismos presentan cambios fisiológicos en la cutícula (que forma parte del exoesqueleto del insecto), la cual se vuelve más gruesa y reduce la penetración del insecticida (Yahouédo et al., 2017).
En otros casos hay cambios metabólicos que se ven reflejados en la producción elevada de enzimas detoxificantes (como citocromos P450, monooxigenasas, esterasas, carboxilesterasas, colinesterasas y glutatión-S-transferasas), que permiten el secuestro o la eliminación del insecticida (Gan et al., 2021). En muchas poblaciones de mosquitos se han encontrado mutaciones genéticas que generan modificaciones en proteínas de membrana celular, las cuales impiden que el insecticida se adhiera a ésta y se evada así su efecto letal (Contreras-Perera et al., 2020).
Los mosquitos que son resistentes a los insecticidas pueden tener una ventaja selectiva sobre los no resistentes, ya que pueden sobrevivir y reproducirse en ambientes que han sido tratados. Sin embargo, la resistencia también puede tener costos ecológicos, debido a la generación de disyuntivas ecológicas (trade-offs en inglés) (Belinato et al., 2016).
Disyuntivas ecológicas y resistencia a insecticidas
Además de la presencia de insecticidas, existen factores abióticos (temperatura, humedad, hábitats disponibles, entre otros) y bióticos (depredadores, competencia entre organismos, patógenos, entre otros) con los cuales un individuo tiene que lidiar al mismo tiempo. Esto puede ser especialmente crítico en ambientes donde la disponibilidad de recursos es limitada o la presión selectiva de otros factores de este tipo es alta. Como resultado, la expresión de la resistencia puede limitar la expresión de otras características o interferir con otros procesos metabólicos/fisiológicos, generando disyuntivas (Garland et al., 2014) (figura 2).
Se ha observado que la sobreproducción de enzimas detoxificantes se debe a la amplificación genética que incrementa el número de copias de esas enzimas (Hemingway et al., 2004). Esta sobreproducción se debe a un metabolismo incrementado (Oliveira et al., 2011), que puede ser hasta de cincuenta veces más cuando el organismo es expuesto al insecticida. Devonshire y Moores (1982) estimaron que la sobreproducción de enzimas detoxificantes puede representar hasta el 3% del total de proteínas corporales. Por esta razón se asume que el uso de recursos para la producción de estas enzimas reduce la energía disponible para otras funciones biológicas.
En mosquitos existe evidencia de los costos asociados con la energía invertida para poder resistir a los insecticidas. Éstos incluyen el incremento en el riesgo de depredación (Berticat et al., 2002), lento desarrollo de larvas (Brito et al., 2013), reducción de la longevidad en adultos (Agnew et al., 2004), decremento en la ingesta de sangre, frecuencia de hembras inseminadas (Belinato et al., 2012) y disminución en la producción y eclosión de huevos (Kumar et al., 2009). Lo anterior se debe a que la selección natural favorece a aquellos individuos que sean capaces de optimizar el uso de los recursos disponibles, incluso si esto significa una reducción en la expresión de la características no asociadas a la resistencia a insecticidas.
Figura 2
Insectos vectores de enfermedades resistentes a insecticidas
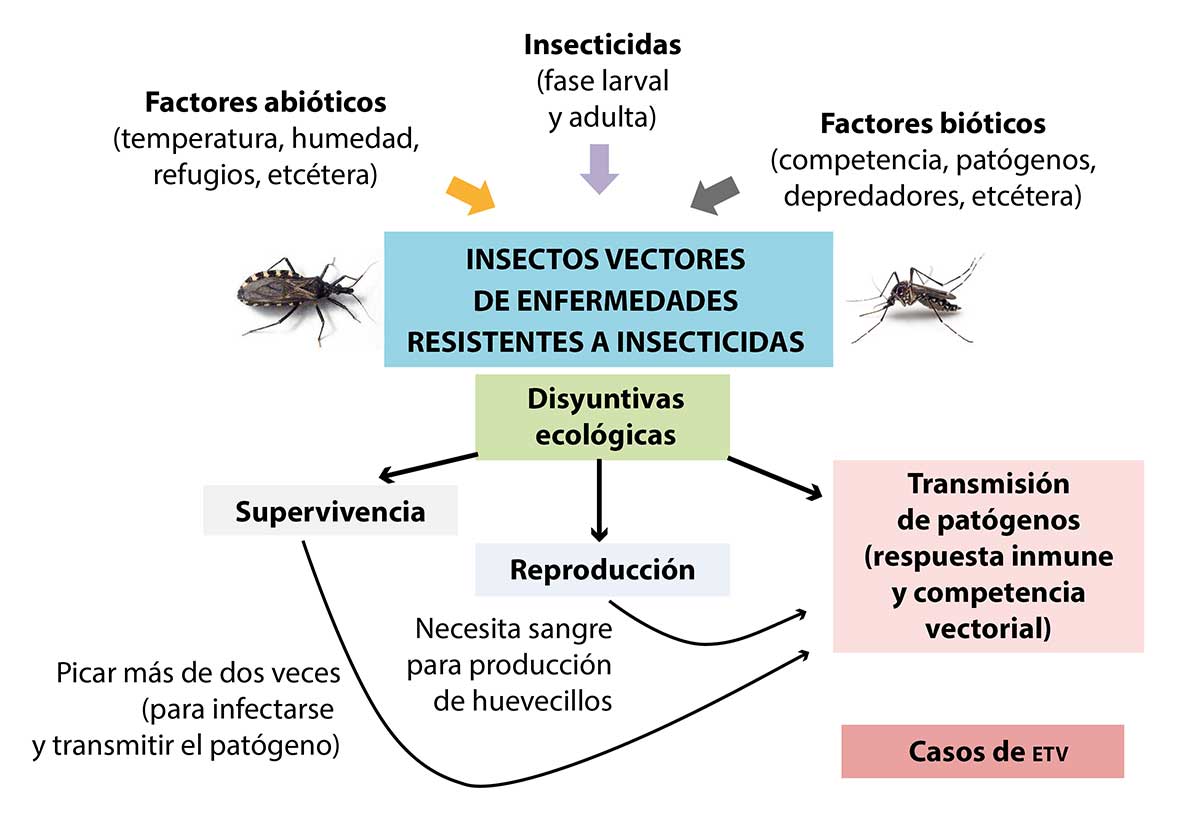
La conexión fisiológica, metabólica y genética, las presiones bióticas y abióticas, y la exposición a insecticidas favorecen las disyuntivas ecológicas en los organismos, lo cual afecta la supervivencia, reproducción y competencia vectorial relacionada con los casos de etv en humanos.
Fuente: Elaboración propia.
Efecto de la resistencia a insecticidas sobre la infección por patógenos
Los virus del dengue, Zika y chikungunya también infectan al mosquito; sin embargo, estos patógenos no parecen causarle daño . A pesar de esto, se sabe que el mosquito desarrolla una respuesta inmune hacia los patógenos (Lowenberger, 2001), mediante una respuesta humoral y celular. Ésta se basa en la producción de moléculas citotóxicas: péptidos antimicrobianos, lisozimas y especies reactivas de oxígeno (ero) (Schmid-Hempel, 2005). La respuesta celular involucra hemocitos con función de fagocitar y encapsular entidades infecciosas (Iwanaga y Lee, 2005).
En exceso, las ero pueden afectar células propias, lo que hace posible que un mosquito expuesto a insecticidas y al mismo tiempo infectado por un patógeno vea afectada su supervivencia, lo que sería bueno desde el punto de vista del control de vectores (Kumar et al., 2003). Sin embargo, en plaga de chinches en cultivos la exposición a insecticidas reduce la cantidad de hemocitos (George y Amborse, 2004), y en algunos casos la capacidad fagocítica y de encapsulación se ve disminuida, lo cual induce una mayor infección (Zibaee y Bandani, 2010).
Los mecanismos de resistencia a insecticidas sobre la infección se desconocen, pero debido a que existe una correlación entre la infección, la respuesta inmune y la exposición a insecticidas, puede darse un efecto indirecto entre genes y moléculas relacionados con la detoxificación de insecticidas y con los mecanismos inmunes (Vontas et al., 2005). Esto podría debilitar el sistema inmunitario del mosquito y reducir su capacidad para combatir la infección viral, afectando la transmisión de patógenos a humanos.
Efectos sobre la competencia vectorial
La competencia vectorial es la facultad que tiene un vector de ser infectado por un patógeno y transmitirlo posteriormente a un organismo sano (Higgs y Beaty, 2005). Como se mencionaba en el apartado anterior, la resistencia a insecticidas puede afectar la expresión de características relacionadas con la respuesta ante patógenos, lo cual afecta la competencia vectorial (Garrett-Jones y Shidrawi, 1969).
Los efectos de la resistencia a insecticidas en la transmisión de enfermedades son complejos y pueden variar según el vector, el patógeno y las condiciones locales. Por ejemplo, altos niveles de enzima carboxilesterasa (relacionados con la degradación y resistencia a insecticidas) en mosquitos del género Culex se relacionan con una menor infección con Wuchereria bancrofti, responsable de la filariasis linfática (o elefantiasis) (McCarroll et al., 2002).
Alout et al. (2014) encontraron que mosquitos del genero Anopheles susceptibles a insecticidas tuvieron una menor probabilidad de infección con parásitos. Lo contrario pasa con los mosquitos resistentes: cuando éstos son expuestos al insecticida, desarrollan una mayor infección (Alout et al., 2016). Estos trabajos muestran los efectos que podrían tener la resistencia y la exposición a insecticidas en la competencia vectorial de los mosquitos.
En Ae. aegypti, la exposición a un organofosforado en larvas resistentes incrementó la susceptibilidad de infección por el virus Sindbis cuando los individuos llegan a estadio adulto (Muturi et al., 2011). En una población resistente a piretroides se observó una mayor infección de virus del dengue, además de un mayor tiempo de vida de la hembra (que entonces puede picar a más personas) (Chen et al., 2021). También se ha observado que esta resistencia a piretroides reduce la diversidad en la microbiota intestinal del mosquito y esto puede hacer que se incremente la susceptibilidad de las hembras a ser infectadas por el virus del Zika (Arévalo-Cortés et al., 2022).
Aunado a esto, las moléculas sobreexpresadas en mosquitos resistentes a insecticidas también podrían ejercer una presión selectiva sobre los patógenos y aumentar con ello la capacidad de los virus para infectar a los mosquitos resistentes a insecticidas (Rivero et al., 2010). Por ello, es posible que un mosquito infectado con un virus y expuesto a insecticidas aumente su carga viral, generando una infección severa en el humano picado (figura 2).
Pérdida de resistencia a insecticidas
Los costos ecológicos son una parte importante de los modelos evolutivos y pueden explicar por qué algunas características evolutivas son desfavorecidas en ciertos contextos (Otto, 2004). Por ejemplo, en el caso del desuso de un insecticida se espera que la resistencia a éste vaya desapareciendo en el transcurso de las generaciones, ya que los recursos ahora estarían canalizados a otras características. Esto llevaría a la desaparición de la resistencia y a volver susceptibles de nuevo a los mosquitos, y los insecticidas en desuso podrían volver a ser efectivos para el control del vector (Machani et al., 2020).
Vera-Maloof et al. (2020) observaron que, en ocho poblaciones de mosquitos Ae. aegypti resistentes a insecticidas piretroides, mantenidas sin exposición durante ocho generaciones, disminuyó hasta sesenta veces la resistencia. Pero también observaron que en otras poblaciones ésta no se revertía. Los autores mencionan que, a pesar de ser poblaciones de la misma especie, cada una tuvo una historia ecológica-evolutiva distinta y que la reversión de la resistencia puede tomar más tiempo en algunas de ellas. Incluso es posible que la resistencia nunca se pierda, por lo que el reúso de insecticidas podría no volverse a dar.
Rotación de insecticidas
Actualmente, la estrategia para tratar de evitar la aparición de resistencia es a través de la rotación de insecticidas. Ésta se basa en no usar insecticidas del mismo grupo (usar piretroides por unas generaciones, después organofosforados, etcétera), para evitar que se favorezcan modificaciones en proteínas que pudieran conferir resistencia a los productos o que se favorezca mosquitos con metabolismos capaces de degradarlos (Yamamura, 2021).
La pregunta que surge es cuándo deberá hacerse la rotación. Para esto se necesita de la evaluación continua de susceptibilidad a los productos usados para el control de vectores. En México los insecticidas se evalúan continuamente mediante pruebas estandarizadas (cenaprece, 2020c) y se considera que un insecticida que mata por arriba del 98% de los mosquitos expuestos es adecuado para su uso, mientras que un porcentaje de 90-97.9% indica una posible resistencia, por lo cual su uso estará restringido; por debajo del 90% de mortalidad, el insecticida no será usado.
Comentarios finales
La resistencia a los insecticidas y la recuperación de la susceptibilidad son un tema central para el control de insectos vectores, ya sean mosquitos, chinches, garrapatas, entre otros. Los principios ecológicos y evolutivos nos permiten entender cómo ha evolucionado la resistencia y también sus posibles efectos sobre los patógenos causantes de las etv. De igual forma, los mecanismos asociados a la resistencia deben ser estudiados para generar estrategias de monitoreo más precisas y oportunas.
Las evaluaciones de susceptibilidad a insecticidas donde los casos de etv son continuos y, por lo tanto, se usan insecticidas, deben darse de manera rutinaria, con la intención de no generar resistencia en poblaciones que aún no la han desarrollado o tratar de reducirla en aquellas poblaciones que la presentan. Un mayor énfasis en el control físico y la participación comunitaria podría ser la mejor opción para evitar lo más que se pueda el uso de insecticidas y los problemas asociados a su aplicación.
Referencias
Agnew, P., Berticat, C., Bedhomme, S., Sidobre, C. y Michalakis, Y. (2004). Parasitism increases and decreases the costs of insecticide resistance in mosquitoes. Evolution, 58, 579-586. https://doi.org/10.1554/03-436
Alout, H. Djègbè, I., Chandre, F., Djogbènou, L. S., Dabirè, R. K., Corbel, V.y Cohuet A. (2014). Insecticide exposure impacts vector-parasite interactions in insecticide-resistant malaria vectors. Proceedings of the Royal Society B: Biological Sciences, 281, 20140389. https://doi.org/10.1098/rspb.2014.0389
Alout, H., Dabirè, R. K., Djogbènou, L. S., Abate, L., Corbel, V., Chandre, F. y Cohuet A. (2016). Interactive cost of Plasmodium infection and insecticide resistance in the malaria vector Anopheles gambiae. Scientific Reports, 6, 29755. https://doi.org/10.1038/srep29755
Arévalo-Cortés, A., Damania, A., Granada, Y., Zuluaga, S., Mejia, R. y Triana-Chávez, O. (2022). Association of midgut bacteria and their metabolic pathways with zika infection and insecticide resistance in colombian Aedes aegypti populations. Viruses, 14, 2197. https://doi.org/10.3390/v14102197
Belinato, T. A. y Martins, A. J. (2016). Insecticide Resistance and Fitness Cost. En: S. Trdan (ed.). Insecticides Resistance (pp. 243-261), InTech. https://doi.org/10.5772/61826
Belinato, T. A., Martins, A. J. y Valle, D. (2012). Fitness evaluation of two Brazilian Aedes aegypti field populations with distinct levels of resistance to the organophosphate temephos. Memórias do Instituto Oswaldo Cruz, 107, 916-922. https://doi.org/10.1590/S0074-02762012000700013
Berticat, C., Rousset, F., Raymond, M., Berthomieu, A. y Weill, M. (2002). High Wolbachia density in insecticide-resistant mosquitoes. Proceedings of the Royal Society B: Biological Sciences, 269, 1413-1416. https://doi.org/10.1098/rspb.2002.2022
Brito, L. P., Linss, J. G. B., Lima-Camara, T. N., Belinato, T. A., Peixoto, A. A., Lima, J. B. P., Valle, D. y Martins, A. J. (2013). Assessing the effects of Aedes aegypti kdr mutations on pyrethroid resistance and its fitness cost. PLoS one, 8, e60878. https://doi.org/10.1371/journal.pone.0060878
Centers for Disease Control and Prevention (2020). Prevención de Picaduras de Mosquito. Cómo Protegerse de las Picaduras de Mosquito. Centers for Disease Control and Prevention, Department of Health and Human Services, usa. https://www.cdc.gov/mosquitoes/pdfs/MosquitoBitePreventionUS_ESP_508.pdf
Centro Nacional de Prevención y Control de Enfermedades (2020a). Guía Metodológica para la Nebulización Espacial ubv. 2ª ed. cenaprece, ssa, México. https://www.gob.mx/cms/uploads/attachment/file/598085/Guia_Metodologica_para_Nebulizacion_Espacial_UBV.pdf
Centro Nacional de Prevención y Control de Enfermedades (2020b). Guía Metodológica para el Rociado Domiciliario. 2ª ed. cenaprece, ssa, México. https://www.gob.mx/cms/uploads/attachment/file/598083/Guia_Metodologica_para_el_Rociado_Domiciliario.pdf
Centro Nacional de Prevención y Control de Enfermedades (2020c). Guía para la Determinación de la Susceptibilidad/Resistencia y Eficacia Biológica a Insecticidas. 2ª ed. cenaprece, ssa, México. https://www.gob.mx/cms/uploads/attachment/file/598093/Guia_para_la_Determinaci_n_de_la_SusceptibilidadResistencia_y_Eficacia_..._compr.pdf
Chareonviriyaphap, T., Bangs, M. J., Suwonkerd, W., Kongmee, M., Corbel, V. y Ngoen-Klan, R. (2013). Review of insecticide resistance and behavioral avoidance of vectors of human diseases in Thailand. Parasite & Vectors, 6, 280. https://doi.org/10.1186/1756-3305-6-280
Chen, T. Y., Smartt, C. T. y Shin, D. (2021). Permethrin resistance in Aedes aegypti affects aspects of vectorial capacity. Insects, 12, 71. https://doi.org/10.3390/insects12010071
Clements, A. N. (1992). The Biology of Mosquitoes: Development, Nutrition and Reproduction (Vol. 1). Chapman & Hall.
Contreras-Perera, Y., Ponce-García, G., Villanueva-Segura, K., López-Monroy, B., Rodríguez-Sánchez, I. P., Lenhart. A., Manrique-Saide, P. y Flores, A. E. (2020). Impact of deltamethrin selection on kdr mutations and insecticide detoxifying enzymes in Aedes aegypti from Mexico. Parasite & Vectors, 13, 224. https://doi.org/10.1186/s13071-020-04093-3
Devonshire, A. L. y G. D. Moores. (1982). A carboxylesterase with broad substrate specificity causes organophosphorous, carbamate and pyrethroid resistance in peach potato aphids (Myzus persicae). Pesticide Biochemistry and Physiology, 18, 235-246. https://doi.org/10.1016/0048-3575(82)90110-9
Deming, R., Manrique-Saide, P., Medina Barreiro, A., Cardeña, E. U. K., Che-Mendoza, A., Jones, B., Liebman, K., Vizcaíno, L.,Vázquez-Prokopec, G. y Lenhart, A. (2016). Spatial variation of insecticide resistance in the dengue vector Aedes aegypti presents unique vector control challenges. Parasites & Vectors, 9, 1-10. https://doi.org/10.1186/s13071-016-1346-3
Ding, F., Fu, J., Jiang, D., Hao, M. y Lin, G. (2018). Mapping the spatial distribution of Aedes aegypti and Aedes albopictus. Acta Tropica, 178, 155-162. https://doi.org/10.1016/j.actatropica.2017.11.020
Fondo de las Naciones Unidas para la Infancia (2016). Control del Vector Aedes aegypti y Medidas Preventivas en el Contexto del Zika. Nota técnica para unicef. https://www.unicef.org/lac/media/1381/file/PD%20Publicaci%C3%B3n%20Control%20del%20vector%20Aedes%20aegypti%20y%20medidas%20preventivas.pdf
Gan, S. J., Leong, Y. Q., bin Barhanuddin, M. F. H., Wong, S. T., Wong, S. F., Mak, J. W. y Ahmad, R. B. (2021). Dengue fever and insecticide resistance in Aedes mosquitoes in Southeast Asia: a review. Parasites & Vectors, 14, 1-19. https://doi.org/10.1186/s13071-021-04785-4
Garrett-Jones, C. y Shidrawi, G. R. (1969). Malaria vectorial capacity of Anopheles gambiae. Bulletin of the World Health Organization, 40, 531-545. https://apps.who.int/iris/bitstream/handle/10665/267721/PMC2556109.pdf
George, P. J. E. y Ambrose, D. P. (2004). Impact of insecticides on the hemogram of Rhynocoris kumarii Ambrose and Livingstone (Hem., Reduviidae). Journal of Applied Entomology, 128, 600-604. https://doi.org/10.1111/j.1439-0418.2004.00896.x
Garland, T. (2014). Trade-offs. Current Biology, 24, R60-R61. https://doi.org/10.1016/j.cub.2013.11.036
Hemingway, J., Hawkes, N. J, McCarroll, L. y Ranson, H. (2004). The molecular basis of insecticide resistance in mosquitoes. Insect Biochemistry and Molecular Biology, 34, 653-665. https://doi.org/10.1016/j.ibmb.2004.03.018
Higgs, S. y Beaty, B. J. (2005). Natural cycles of vector-borne pathogens. En: Marquardt, W. C. (ed.). Biology of Disease Vectors (pp. 167-185). 2nd ed. Elsevier Academic Press.
Iwanaga, S. y Lee, B. L. (2005). Recent advances in the innate immunity of invertebrate animals. Journal of Biochemistry and Molecular Biology, 38, 128-150. https://doi.org/10.5483/BMBRep.2005.38.2.128
Kumar, S., Christophides, G. K., Cantera, R., Charles, B., Soo Han, Y., Meister, S., Dimopoulos, G., Kafatos, F. C. y Barillas-Mury, C. (2003). The role of reactive oxygen species on Plasmodium melanotic encapsulation in Anopheles gambiae. Proceedings of the National Academy of Science usa, 100, 14139-14144. https://doi.org/10.1073/pnas.203626210
Kumar, S., Thomas, A., Samuel, T., Sahgal, A., Verma, A. y Pillai, M. K. (2009). Diminished reproductive fitness associated with the deltamethrin resistance in an Indian strain of dengue vector mosquito, Aedes aegypti L. Tropical Biomedicine, 26, 155-64. https://drive.google.com/file/d/0B75lcx0mfp2OTllBaGMzZ0xzNEE/view?pli=1&resourcekey=0-2PytjhDbQCIkdubhea9X1g
Kuri-Morales, P. A., Correa-Morales, F., González-Acosta, C., Moreno-García, M., Santos-Luna, R., Román-Pérez, S., Salazar-Penagos, F., Lombera-González, M., Sánchez-Tejeda, G. y González-Roldán, J. F. (2017). Insecticide susceptibility status in Mexican populations of Stegomyia aegypti (=Aedes aegypti): a nationwide assessment. Medical and Veterinary Entomology, 32, 162-174. https://doi.org/10.1111/mve.12281
Lowenberger, C. (2001). Innate immune response of Aedes aegypti. Insect Biochemistry and Molecular Biology, 31, 219-229. https://doi.org/10.1016/S0965-1748(00)00141-7
Machani, M. G., Ochomo, E., Zhong, D., Zhou, G., Wang, X., Githeko, A. K., Yan, G., y Afrane Y. A. (2020). Phenotypic, genotypic and biochemical changes during pyrethroid resistance selection in Anopheles gambiae mosquitoes. Scientific Reports, 10, 19063. https://doi.org/10.1038/s41598-020-75865-1
McCarroll, L. y Hemingway, J. (2002). Can insecticide resistance status affect parasite transmission in mosquitoes? Insect Biochemistry and Molecular Biology, 32, 1345-1351. https://doi.org/10.1016/s0965-1748(02)00097-8
Metz, H. C., Miller, A. K., You, J., Akorli, J., Avila, F. W., Buckner, E. A., Kane, P., Otoo, S., Ponlawat, A., Triana-Chávez, O., Williams, K. F. y McBride, C. S. (2023). Evolution of a mosquito’s hatching behavior to match its human-provided habitat. The American Naturalist, 201, 200-214. https://doi.org/10.1086/722481
Muktar, Y., Tamerat, N. y Shewafera, A. (2016). Aedes aegypti as a vector of flavivirus. Journal of Tropical Disease, 4, 2. https://doi.org/10.4172/2329-891X.1000223
Muturi, E. J., Ephantus, J., Costanzo, K., Kesavaraju, B. y Alto, B. W. (2011). Can pesticides and larval competition alter susceptibility of Aedes mosquitoes (Diptera: Culicidae) to arbovirus infection? Journal of Medical Entomology, 48, 429-436. https://doi.org/10.1603/ME10213
Oliveira, J. H. M., Gonçalves, R. L. S., Oliveira, G. A., Oliveira, P. L., Oliveira, M. F. y Barillas-Mury, C. (2011). Energy metabolism affects susceptibility of Anopheles gambiae mosquitoes to Plasmodium infection. Insect Biochemistry and Molecular Biology, 41, 349-355. https://doi.org/10.1016/j.ibmb.2011.02.001
Organización Mundial de la Salud (1975). Manual de Entomología Práctica del Paludismo. Parte II. Métodos y técnicas. oms. https://apps.who.int/iris/bitstream/handle/10665/42481/WHO_OFFSET_13_(part2).pdf?sequence=2
Organización Mundial de la Salud (2012). Plan Mundial para la Gestión de la Resistencia a los Insecticidas en los Vectores del Paludismo. oms. https://apps.who.int/iris/bitstream/handle/10665/44846/9789241564472_eng.pdf?sequence=1
Organización Mundial de la Salud (2017). Respuesta mundial para el control de vectores, 2017-2030. oms. https://www.paho.org/es/documentos/respuesta-mundial-para-controlvectores-2017-2030-0
Organización Mundial de la Salud (2020). Enfermedades Transmitidas por Vectores. oms. https://www.who.int/es/news-room/fact-sheets/detail/vector-borne-diseases
Otto, S. P. (2004). Two steps forward, one step back: the pleiotropic effects of favoured alleles. Proceedings of the Royal Society B: Biological Sciences, 271, 705-14. https://doi.org/10.1098/rspb.2003.2635
Rodríguez-Cruz, R. (2002). Estrategias para el control del dengue y del Aedes aegypti en las Américas. Revista Cubana de Medicina Tropical, 54, 189-201. http://scielo.sld.cu/scielo.php?script=sci_arttext&pid=S0375-7602002000300004
Rivero, A., Vézilier, J., Weill, M., Read, A. F. y Gandon, S. (2010). Insecticide control of vectorborne diseases: when is insecticide resistance a problem? PLoS Pathogens, 6, e1001000. https://doi.org/10.1371/journal.ppat.1001000
Schmid-Hempel, P. (2005). Evolutionary ecology of insect immune defences. Annual Review of Entomology, 50, 529-551. https://doi.org/10.1146/annurev.ento.50.071803.130420
Vera-Maloof, F. Z, Saavedra-Rodríguez, K., Penilla-Navarro, R. P., Rodríguez-Ramírez, A., Dzul, F., Manrique-Saide, P. y Black, W. C. (2020). Loss of pyrethroid resistance in newly established laboratory colonies of Aedes aegypti. PLoS Neglected Tropical Diseases, 14, e0007753. https://doi.org/10.1371/journal.pntd.0007753
Vontas, J., Blass, C., Koutsos, A. C., David, J.-P., Kafatos, F. C., Louis, C., Hemingway, J., Christophides, G. K. y Ranson H. (2005). Gene expression in insecticide resistant and susceptible Anopheles gambiae strains constitutively or after insecticide exposure. Insect Molecular Biology, 14, 509-521. https://doi:10.1111/j.1365-2583. 2005.00582.x
Webb Jr., J. L. A. (2016). Aedes aegypti suppression in the Americas: historical perspectives. The Lancet, 388, 556-557. https://doi.org/10.1016/s0140-6736(16)31225-9
Yahouédo, G. A., Chandre, F., Rossigno, M., Ginibre, C., Balabanidou, V., Mendez, N. G. A., Pigeon, O., Vontas, J. y Cornelie, S. (2017). Contributions of cuticle permeability and enzyme detoxification to pyrethroid resistance in the major malaria vector Anopheles gambiae. Scientific Reports, 7, 11091. https://doi.org/10.1038/s41598-017-11357-z
Yamamura, K. (2021). Optimal rotation of insecticides to prevent the evolution of resistance in a structured environment. Population Ecology, 63, 190-203. https://doi.org/10.1002/1438-390X.12090
Zibaee, A. y Bandani, A. R. (2010). Effects of Artemisia annua L. (Asteracea) on the digestive enzymatic profiles and the cellular immune reactions of the Sunn pest, Eurygaster integriceps (Heteroptera: Scutellaridae), against Beauveria bassiana. Bulletin of Entomological Research, 100, 185-196. https://doi:10.1017/S0007485309990149