Messenger rna (mrna), a molecule with potential therapeutic and preventive application
Gabriela Rosas
orcid: 0000-0002-9902-308X
Facultad de Medicina, Universidad Autónoma del Estado de Morelos (uaem)
Raúl José Bobes Ruiz
orcid: 0000-0003-2553-5661
Instituto de Investigaciones Biomédicas, Universidad Nacional Autónoma de México (unam)
Jacquelynne Cervantes Torres
orcid: 0000-0002-2610-2860
Facultad de Medicina Veterinaria y Zootecnia, Universidad Nacional Autónoma de México (unam)
Edda Sciutto
orcid: 0000-0001-5608-5355
Instituto de Investigaciones Biomédicas, Universidad Nacional Autónoma de México (unam)
Gladis Fragoso
orcid: 0000-0003-3885-1858
Instituto de Investigaciones Biomédicas, Universidad Nacional Autónoma de México (unam)
resumen
Los ácidos nucleicos (adn y arn) tienen la importante función de almacenar, expresar y transmitir la información genética de los seres vivos. El adn actúa como "repositorio" de la información, en el núcleo de las células, y el arn mensajero (mrna) transmite esa información al sitio de síntesis. Esta propiedad permite utilizar al mRNA como agente terapéutico o para la generación de inmunidad contra organismos patógenos. En particular es interesante el diseño de vacunas basadas en mrna que se han probado con éxito contra el covid-19, además del uso del mrna contra enfermedades no infecciosas, entre ellas la diabetes tipo 1, la hemofilia, el asma y ciertos tipos de cáncer, incluyendo el melanoma. Las posibilidades terapéuticas del mrna son muy amplias.
palabras clave
mrna, vacunas, enfermedades crónicas, inmunización, tratamiento novedoso
abstract
Nucleic acids (dna and rna) have the important function of storing, expressing and transmitting the genetic information of living beings. dna acts as an information "repository" in the cells nucleus, and the messenger rna (mrna) "transmits" that information to the site of synthesis. This property allows mrna to be used as a therapeutic agent or for the generation of immunity against pathogenic organisms. Particularly interesting is the design of mrna -based vaccines, which have been successfully tested against covid-19, in addition to the use of mrna against non-infectious diseases, including type 1 diabetes, hemophilia, asthma and certain types of cancer, including melanoma. The therapeutic possibilities of mrna are very broad.
key words
mrna, vaccines, chronic diseases, immunization, novel treatment
Generalidades del adn y del arn
El principio de la vida se basa en la presencia de dos macromoléculas conocidas como ácido desoxirribonucleico (adn o dna, por las siglas en inglés de deoxyribonucleic acid) y ácido ribonucleico (arn o rna, por las siglas en inglés de ribonucleic acid), cuya función radica en almacenar, expresar y transmitir la información genética de los seres vivos. Algunos organismos, como los virus, sólo contienen arn, mientras que la mayor parte de los seres vivos contienen además adn.
Estas macromoléculas están constituidas por cuatro moléculas conocidas como bases nitrogenadas, que para el caso del adn son adenina (A), timina (T), guanidina (G) y citosina (C); mientras que para el arn son uracilo (U), adenina, guanidina y citosina. Cada una de estas bases se acopla a un azúcar (ribosa) para dar lugar a los nucleósidos, los cuales se unen a un grupo fosfato (po4¯) para interaccionar entre ellos, lo que da lugar a los nucleótidos (figura 1). Esta interacción se da entre la adenina y la timina o el uracilo, así como entre la guanidina y la citosina. A partir de estas moléculas se genera un lenguaje particular y único que le indica a una célula qué proteína deberá formarse. Este lenguaje está sujeto a la combinación de tres nucleótidos que crean una estructura llamada codón, y la combinación de varios codones conforma un gene.
Figura 1
Estructura representativa de un nucleótido
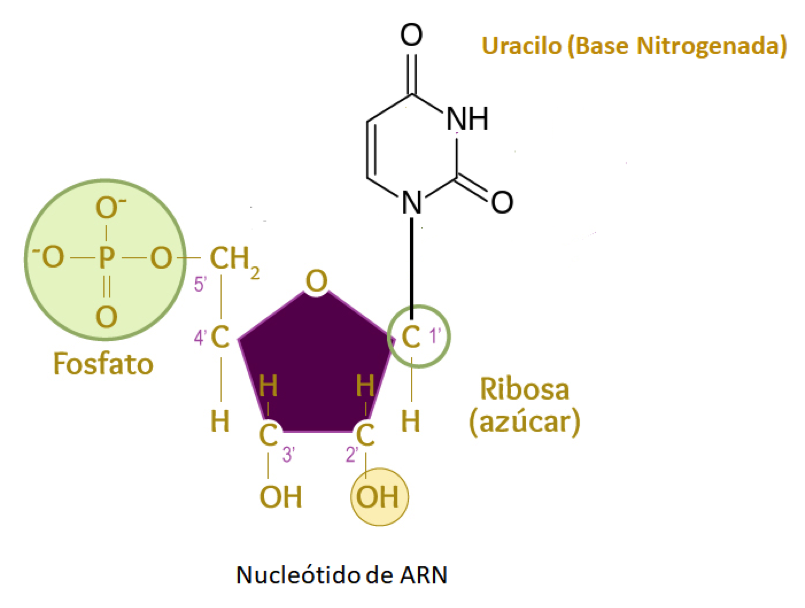
El nucleótido se constituye por un grupo fosfato que se une al carbono 5' de un azúcar de cinco carbonos (pentosa), que en este caso corresponde a la ribosa, y cuyo carbono 1' se une a la base nitrogenada que se representa como un uracilo.
Fuente: Elaboración propia.
Un codón codifica para los aminoácidos, que son la base estructural de las proteínas, y la particular organización de los nucleótidos en codones ha sido denominada código genético. Así, la información genética de un individuo está contenida en el adn, el cual traduce el mensaje en forma de arn (proceso conocido como transcripción), y a partir del arn que queda como mensajero (mrna) se sintetizan las proteínas (proceso conocido como traducción). Si bien ésta es una descripción muy general de la formación de las proteínas, lo importante es enfatizar que, a la vista del actual conocimiento, es el adn y no el arn el que puede, bajo ciertas circunstancias, modificar la genética de un individuo.
El mrna como potencial agente terapéutico para enfermedades no infecciosas
Sin duda, en los últimos años hemos sido testigos de la revolución científica biotecnológica, en la cual destacan las estrategias de secuenciación masiva del adn, las cuales han permitido identificar las variaciones genéticas que pueden influir en una expresión adecuada de proteínas, y esto puede desencadenar el desarrollo de diferentes enfermedades. La posibilidad de crear una medicina más dirigida a través de la inyección del mrna que codifica a la proteína que el paciente no produce en las cantidades adecuadas, o la produce con alteraciones debido a cambios genéticos o modificaciones postraduccionales, ha abierto una nueva ventana de oportunidades para la medicina terapéutica personalizada (Sahin et al., 2014).
Se observó que la gran ventaja de inyectar el mrna en lugar del adn es que éste requiere entrar al núcleo de la célula para de ahí dar lugar al mrna, mientras que la inyección directa del mrna no necesita entrar al núcleo, sino que la proteína en cuestión puede expresarse directamente en el citosol (Sahin et al., 2014). Relacionado con esto, queda implícito que el arn, a diferencia del adn, no tiene posibilidades de integrarse al genoma del individuo, al no entrar al núcleo, lo que aumenta la seguridad de este tipo de intervención.
El principio de emplear al mrna como agente terapéutico implica su producción y purificación in vitro para posteriormente inyectarlo al individuo y que se introduzca a la célula diana, cuya maquinaria de expresión de proteínas producirá la proteína funcional correspondiente (figura 3b). Desde los primeros experimentos con inyecciones de mrna en el músculo de ratones (Wolf et al., 1990) se han realizado múltiples ensayos y estudios de fases clínicas, los cuales han demostrado el potencial de esta macromolécula para tratar patologías asociadas a una baja o ineficiente expresión de una proteína en particular; para este tipo de intervención se acuñó el término farmacología del mrna (Kallen y Theß et al., 2014).
La tabla 1 presenta algunos de los estudios que han empleado la introducción de mrna con potencial terapéutico, de manera importante buscando el reemplazo de una proteína (Tabla 1). Como se observa, se han realizado esfuerzos para proponer terapias para enfermedades hematológicas (anemia), oncológicas (cáncer de mama, neuroblastoma, linfoma), cardiacas (miocarditis autoinmune), metabólicas (hipercolesterolemia, amiloidosis, acidemia metilmalónica, diabetes) y otras enfermedades (fibrosis pulmonar y hepática, porfiria aguda, fibrosis quística y alergias).
Tabla 1
Terapias propuestas para el reemplazo de proteínas empleando mrna
| Enfermedad |
Proteína a reemplazar mediante el mrna |
Referencia |
| Diabetes autoinmune |
il-4
| Creusot et al., 2010
|
| Diabetes insípida |
Vasopresina |
Jirikowski et al., 1992 |
| Anemia |
Eritropoyetina |
Karikó et al., 2012 |
| Asma |
FoxP3 |
Mays et al., 2013 |
| Desorden del ciclo de la urea |
Arginasa 1 |
Asrani et al., 2018 |
| Acidemia metilmalónica |
Metilmalonil-Coenzima A mutasa |
An et al., 2017 |
| Infarto de miocardio |
Factor de crecimiento vascular endotelial |
Zangi et al., 2013 |
| Melanoma |
Bax |
Okumura et al., 2008 |
| Miocarditis autoinmune |
il-10 |
Zimmermann et al., 2012 |
| Procesos inflamatorios exacerbados |
il-10 |
Levy et al., 2013 |
| Fibrosis quística |
Regulador de la conductancia transmembranal |
Robinson et al., 2018 |
| Porfiria aguda |
Porfobilinógeno deaminasa |
Jiang et al., 2018 |
| Hemofilia |
Factor ix de la coagulación (fix) |
DeRosa et al., 2016 |
El nucleótido se constituye por un grupo fosfato que se une al carbono 5' de un azúcar de cinco carbonos (pentosa), que en este caso corresponde a la ribosa, y cuyo carbono 1' se une a la base nitrogenada que se representa como un uracilo.
Fuente: Elaboración propia.
La base del éxito de las terapias basadas en la inyección del mrna radica, por un lado, en su capacidad de evitar el reconocimiento por parte del sistema inmune innato, y, por otro, en optimizar su entrada a la célula blanco en la que se expresará la proteína en cuestión.
Cuando una célula se encuentra con el arn (sea mensajero o de otro tipo), éste es reconocido por un conjunto de moléculas de la célula (conocidas como receptores) del sistema inmune innato; dentro de éstos se encuentran los tlr3 y tlr7/8, que detectan el arn de doble cadena y el arn de cadena sencilla, respectivamente, así como los receptores tipo rig-1 (por las siglas en inglés de retinoic acid inducible gene), que detectan el arn corto de doble cadena. La detección del mrna por estos receptores inhibe su transcripción para producir la proteína que codifica (Hornung et al., 2008; Karikó et al., 2004), pero además despierta una respuesta inmunoinflamatoria (Wang et al., 2021), la cual, se ha demostrado, genera un severo daño en los animales que han recibido el arn.
Karikó et al. (2005) y Weissman (2015) hicieron una importante contribución para evitar el reconocimiento del arn del sistema inmune innato: reemplazaron la uridina por pseudouridina (nucleósido que existe en la naturaleza, principalmente en otro tipo de arn conocido como de transferencia o rnat) (Figura 2), proceso que además permitió incrementar la producción de la proteína hasta mil veces más con respecto al arn no modificado. Por otro lado, se conoce que los mrna que contienen la modificación de N1-metilpseudouridina (m1Ψ), sola o en combinación con 5-metilcitidina (m5C), superaron a la actual plataforma de mrna de última generación modificada con pseudouridina (Ψ) o m5C/Ψ, pues proporcionaron ~44 veces (cuando se comparan mrna doblemente modificados) o ~13 veces (cuando se comparan mrna modificados individuales) una mayor expresión del gen informador tras la transfección en líneas celulares o ratones, respectivamente (Andries et al., 2015). Esta importante contribución sentó las bases de la forma en la que actualmente se preparan las formulaciones de terapias basadas en la administración de mrna, ya sea con fines terapéuticos o como vacunas (Figura 3).
Figura 2
Estructura química de la uridina y la pseudouridina
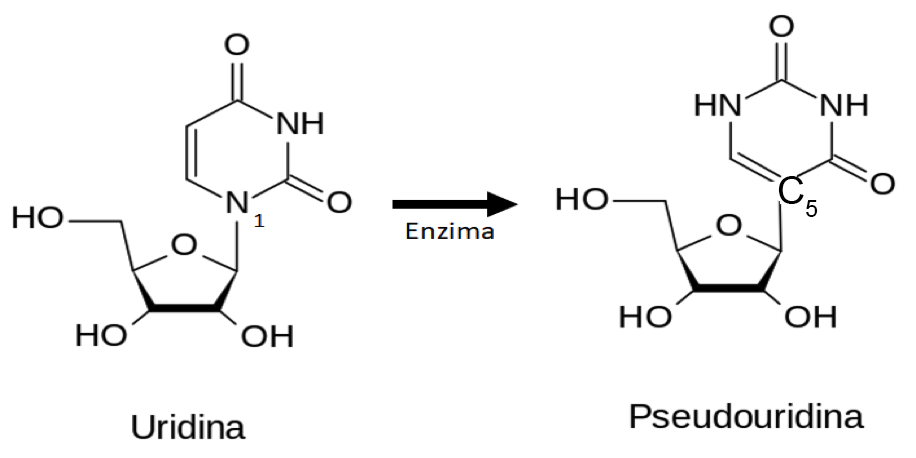
La principal diferencia de estas dos bases nitrogenadas para la formación del nucleótido es que la uridina se une a la pentosa por medio del nitrógeno 1, mientras que la pseudouridina lo hace por el carbono 5.
Fuente: Elaboración propia.
Con respecto a la optimización de la entrada del mrna a la célula blanco, se han propuesto distintos materiales seleccionados con base en las propiedades fisicoquímicas del mrna (tamaño y carga electrostática). Dentro de éstos destacan los lípidos y materiales tipo lípidos conocidos como lipoides, con los cuales se han preparado formulaciones como liposomas, nanopartículas lipídicas (npl o lpn, por las siglas en inglés de lipid nanoparticles) o emulsiones lipídicas (Weng et al., 2020).
Figura 3
Inyección del mRNA como estrategia de vacunación y como terapia de reemplazo
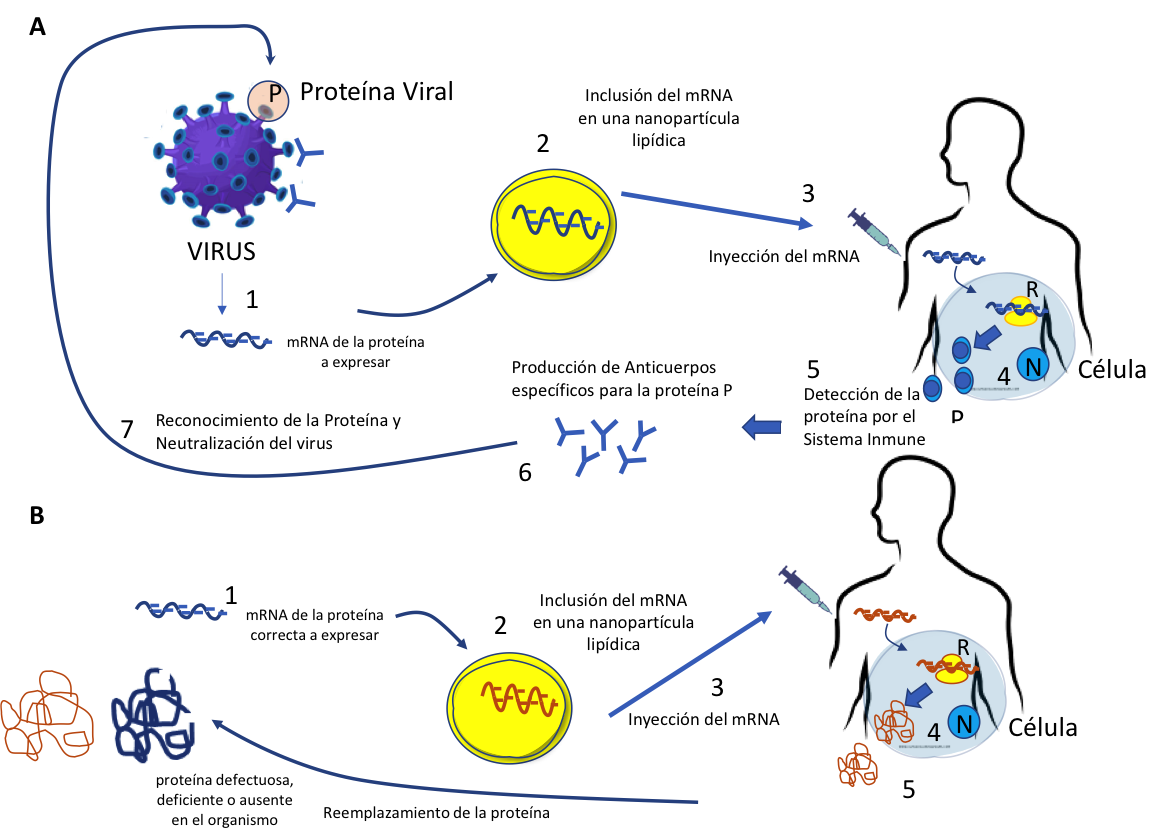
A. Inyección del mrna como estrategia de vacunación. Una vez que se identifica la proteína con capacidades inmunogénicas y protectoras, se produce el mrna que la sintetiza, sustituyendo el uracilo por pseudouracilo para proteger el mrna del reconocimiento por parte del sistema inmune (1). El mrna se formula con una nanopartícula lipídica para favorecer su entrada a la célula blanco (2). Una vez que el mrna formulado se inyecta intramuscularmente (3), éste se introduce en la célula blanco, donde se acoplará a los ribosomas que se encuentran en el citosol para producir la proteína inmunogénica (4), la cual se liberará al espacio extracelular, donde será reconocida por células de la respuesta inmune innata (células dendríticas) (5). Después de varios eventos de maduración de la respuesta inmune se producen anticuerpos específicos (6) y células de la respuesta adaptativa (linfocitos T y B), los cuales, en conjunto, protegerán al organismo contra el virus infeccioso. Los anticuerpos son capaces de reconocer la proteína y así evitar que, a través de ella, el virus pueda infectar a las células blanco (7).
B. Inyección del mrna como terapia de reemplazo de proteínas ausentes, funcionalmente deficientes o defectuosas. El mecanismo de producción de la proteína deficiente o ausente es muy similar al descrito para vacunas, sólo que en este caso, como la proteína a reemplazar la expresa el organismo, éste no la reconoce como ajena y, por lo tanto, no se despierta una respuesta inmune contra ella. N: núcleo, P: proteína, R: ribosomas.
Fuente: Elaboración propia.
Vacunas de mrna para el control de agentes patógenos
Inicialmente se hicieron algunos ensayos para transferir el mrna como fuente de vacuna al individuo introduciendo células dendríticas autólogas transfectadas ex vivo con el mrna en cuestión (Benteyn et al., 2015; Boczkowski et al., 1996; Heiser et al., 2002; Koido et al., 2000). Este proceso resulta muy eficiente en términos de vacunación, ya sea de forma preventiva o terapéutica, ya que las células dendríticas se dirigirán a los órganos linfoides, en donde pueden presentar el antígeno o la proteína que se expresa a partir del mrna que se introdujo en ellas.
Por otro lado, esta forma de introducir el mrna dentro de las células lo protege de una posible degradación, puesto que impide el comienzo de una respuesta inmune contra el propio mrna, y también resuelve el problema de entrega del mrna dentro de las células, para que a partir de ellas se exprese la proteína en cuestión. A la capacidad de una molécula de inducir una respuesta inmune se le conoce como inmunogenicidad. Como se mencionó anteriormente, los primeros ensayos de la introducción del mrna al organismo sin emplear células dendríticas como vehículo de entrada y sistema de expresión de la proteína mostraron que el organismo es capaz de despertar una respuesta inmunoinflamatoria mediada por el mrna, vía receptores de reconocimiento.
La introducción del mrna en células ex vivo también es una estrategia para impedir su degradación, dada la gran abundancia de rnasas (enzimas que degradan al arn), ya sea en el medio ambiente o a nivel extracelular. Sin embargo, este procedimiento resulta costoso y laborioso, pues requiere obtener células dendríticas del propio individuo (Heiser et al., 2002). Las contribuciones de Karikó (2005) y Weissman (2015), al modificar el arn y prevenir que sea reconocido por los receptores de la respuesta innata, cambiaron sin duda el curso de lo que hoy se conoce como vacunas de mrna.
Como se observa en la tabla 2, se han elaborado vacunas basadas en mrna que se encuentran en distintas fases de estudios preclínicos y clínicos contra diversos patógenos causantes de enfermedades infecciosas, principalmente virales, como el vih sida (Bogers et al., 2015; Pollard et al., 2013), chikunguña (August et al., 2021), rabia (Aldrich et al., 2021; Alberer et al., 2017), zika (Medina et al., 2021), ébola (Meyer et al., 2018), influenza (Bahl et al., 2017), así como otras vacunas experimentales contra parásitos como el de la malaria (Mallory et al., 2021) y la toxoplasmosis (Luo et al., 2017) (Tabla 2).
Los avances obtenidos en el desarrollo de vacunas basadas en mrna permitieron rápidamente el desarrollo de vacunas contra el virus SARS-CoV-2, lo cual ha contribuido críticamente al control de la pandemia. Dos vacunas basadas en mrna se liberaron al mercado para su aplicación, la de Pfizer-Biontech y la de Moderna (Lamb 2021; Mahase, 2020); ambas emplean el sistema de modificación de los nucleósidos de uridina por pseudouridina, lo que brinda mayor estabilidad al mrna, y ambas formulan la vacuna empleando npl, que ha mostrado eficacia para su administración intramuscular (Hassett et al., 2019).
Tabla 2
Vacunas en distintos estados de estudios clínicos dirigidas a enfermedades virales humanas
| Agente infeccioso |
Nombre de la vacuna (patrocinador) |
Fase de estudio |
Referencia o número de registro del ensayo clínico |
| Chikunguña |
mrna-1944 (Moderna)
| Fase I
| nct03829384
|
| Rabia |
cv7201 (CureVac) |
Fase I |
nct02241135 |
| Influenza |
val-339851 (Moderna)
mrna-1010 (Moderna) |
Fase I
Fase II |
nct03345043
nct04956575 |
| Zika |
mrna-1893 (Moderna) |
Fase I |
nct04917861 |
| Ébola |
Ad26.zebov (Janssen)
mva-bn-Filo (Janssen) |
Fase III |
nct02509494 |
| Virus sincicial respiratorio |
mrna-1345 (Moderna) |
Fase I |
nct04528719 |
| Virus de inmunodeficiencia humana (vih) |
mrna-1644 (Moderna)
mrna-1644v2-Core (Moderna) |
Fase I |
nct05001373 |
| Citomegalovirus |
mrna-1647 (Moderna) |
Fase II |
nct04232280 |
| sars-cov-2 |
mrna-1273 (Moderna)
bnt162b2 (Pfizer-Biontech) |
Aprobada
Aprobada |
Lamb, 2021
Mahase, 2020 |
Fuente: Elaboración propia.
Este sistema de presentación de nanopartículas lipídicas se estabiliza utilizando polietilenglicol, el cual genera una capa hidrofílica que aumenta la vida media del mrna vacunal. Si bien estas presentaciones han generado el aumento de la estabilidad, se han descrito algunas reacciones alérgicas que parecen estar asociadas al peg, pero se han revertido sin daños colaterales de gravedad.
Una vez que el mrna ha ingresado al organismo, éste se introduce a las células y emplea la maquinaria de la propia célula para sintetizar la proteína en un inmunógeno, el cual será reconocido por el sistema inmune y despertará una respuesta inmune humoral (representada por anticuerpos) y celular (representada por células T y B) que nos protegerá de la infección o de un proceso patológico grave (figura 3a).
Conclusiones y perspectivas
Esta breve descripción de algunas posibilidades terapéuticas del rna claramente lo señalan como una plataforma muy prometedora para el desarrollo de nuevas terapias personalizadas y vacunas de alta eficiencia en el control de diferentes enfermedades. Actualmente, existe un área de intensa investigación que persigue el aumento de la estabilidad de esta molécula para lograr mayor eficiencia y versatilidad de esta nueva herramienta, que representa un nuevo arsenal para el mejoramiento de la salud humana y animal.
Referencias
Alberer, M., Gnad-Vogt, U., Hong, H. S., Mehr, K. T., Backert, L., Finak, G., Gottardo, R., Bica, M. A., Garofano, A., Koch, S. D., Fotin-Mleczek, M., Hoerr, I., Clemens, R. y Von Sonnenburg, F. (2017). Safety and immunogenicity of a mrna rabies vaccine in healthy adults: an openlabel, non-randomised, prospective, first-in-human phase 1 clinical trial. The Lancet, 390(10101), 1511-1520. https://doi.org/10.1016/S0140-6736(17)31665-3
Aldrich, C., Leroux-Roels, I., Huang, K. B., Bica, M. A., Loeliger, E., Schoenborn-Kellenberger, O., Walz, L., Leroux-Roels, G., Von Sonnenburg, F. y Oostvogels, L. (2021). Proof-ofconcept of a low-dose unmodified mrna-based rabies vaccine formulated with lipid nanoparticles in human volunteers: A phase 1 trial. Vaccine, 39(8), 1310-1318. https://doi.org/10.1016/j.vaccine.2020.12.070
An, D., Schneller, J. L., Frassetto, A., Liang, S., Zhu, X., Park, J. S., Theisen, M., Hong, S. J., Zhou, J., Rajendran, R., Levy, B., Howell, R., Besin, G., Presnyak, V., Sabnis, S., Murphy-Benenato, K. E., Kumarasinghe, E. S., Salerno, T., Mihai, C., Lukacs, C. M., Chandler, R. J., Guey, L. T., Venditti, C. P. y Martini, P. G. V. (2017). Systemic messenger rna therapy as a treatment for methylmalonic acidemia. Cell Reports, 21(12), 3548-3558. https://doi.org/10.1016/j.celrep.2017.11.081
Andries, O., Mc Cafferty, S., De Smedt, S. C., Weiss, R., Sanders, N. N., Kitada, T. (2015). N1-methylpseudouridine-incorporated mrna outperforms pseudouridine-incorporated mrna by providing enhanced protein expression and reduced immunogenicity in mammalian cell lines and mice. Journal of Controlled Release, 217, 337-44. https://doi.org/10.1016/j.jconrel.2015.08.051
Asrani, K. H., Cheng, L., Cheng, C. J. y Subramanian, R. R. (2018). Arginase I mrna therapy. A novel approach to rescue arginase 1 enzyme deficiency. rna Biology, 15(7), 914-922. https://doi.org/10.1080/15476286.2018.1475178
August, A., Attarwala, H. Z., Himansu, S., Kalidindi, S., Lu, S., Pajon, R., Han, S., Lecerf, J. M., Tomassini, J. E., Hard, M., Ptaszek, L. M., Crowe, J. E. y Zaks, T. (2021). A phase 1 trial of lipid-encapsulated mrna encoding a monoclonal antibody with neutralizing activity against Chikungunya virus. Nature Medicine, 27(12), 2224-2233. https://doi.org/10.1038/s41591-021-01573-6
Bahl, K., Senn, J. J., Yuzhakov, O., Bulychev, A., Brito, L. A., Hassett, K. J., Laska, M. E., Smith, M., Almarsson, Ö., Thompson, J., Ribeiro, A. M., Watson, M., Zaks, T. y Ciaramella, G. (2017). Preclinical and clinical demonstration of immunogenicity by mrna vaccines against h10n8 and h7n9 influenza viruses. Molecular Therapy, 25(6), 1316-1327. https://doi.org/10.1016/j.ymthe.2017.03.035
Benteyn, D., Heirman, C., Bonehill, A., Thielemans, K. y Breckpot, K. (2015). mrna-based dendritic cell vaccines. Expert Review of Vaccines, 14(2), 161-176. https://doi.org/10.1586/14760584.2014.957684
Boczkowski, D., Nair, S. K., Snyder, D. y Gilboa, E. (1996). Dendritic cells pulsed with rna are potent antigen-presenting cells in vitro and in vivo. Journal of Experimental Medicine, 184(2), 465-472. https://doi.org/10.1084/jem.184.2.465
Bogers, W. M., Oostermeijer, H., Mooij, P., Koopman, G., Verschoor, E. J., Davis, D., Ulmer, J. B., Brito, L. A., Cu, Y., Banerjee, K., Otten, G. R., Burke, B., Dey, A., Heeney, J. L., Shen, X., Tomaras, G. D., Labranche, C., Montefiori, D. C., Liao, H. X., Haynes, B., Geall, A. J. y Barnett, S. W. (2015). Potent immune responses in rhesus macaques induced by nonviral delivery of a self-amplifying rna vaccine expressing hiv type 1 envelope with a cationic nanoemulsion. The Journal of Infectious Diseases, 211(6), 947-955. https://doi.org/10.1093/infdis/jiu522
Creusot, R. J., Chang, P., Healey, D. G., Tcherepanova, I. Y., Nicolette, C. A. y Fathman, C. G. (2010). A short pulse of il-4 delivered by dcs electroporated with modified mrna can both prevent and treat autoimmune diabetes in nod mice. Molecular Therapy, 18(12), 2112-20. https://doi.org/10.1038/mt.2010.146
DeRosa, F., Guild, B., Karve, S., Smith, L., Love, K., Dorkin, J. R., Kauffman, K. J., Zhang, J., Yahalom, B., Anderson, D. G. y Heartlein, M. W. (2016). Therapeutic efficacy in a hemophilia B model using a biosynthetic mrna liver depot system. Gene Therapy, 23, 699-707. https://doi.org/10.1038/gt.2016.46
Hassett, K. J., Benenato, K. E., Jacquinet, E., Lee, A., Woods, A., Yuzhakov, O., Himansu, S., Deterling, J., Geilich, B. M., Ketova, T., Milhai, C., Lyyn, A., McFyden, I., Moore, M. J., Seen, J. J., Stanton, M. G., Almarsson, Ö., Ciaramella, G. y Brito, L. A. (2019). Optimization of lipid nanoparticles for intramuscular administration of mrna vaccines. Molecular Therapy Nucleic Acids, 15, 1-11. https://doi.org/10.1016/j.omtn.2019.01.013
Heiser, A., Coleman, D., Dannull, J., Yancey, D., Maurice, M. A., Lallas, C. D., Dahm, P., Niedzwiecki, D., Gilboa, E. y Vieweg, J. (2002). Autologous dendritic cells transfected with prostatespecific antigen rna stimulate ctl responses against metastatic prostate tumors. The Journal of Clinical Investigation, 109(3), 409-17. https://doi.org/10.1172/jci14364
Hornung, V., Barchet, W., Schlee, M. y Hartmann, G. (2008). rna recognition via tlr7 and tlr8. Handbook of Experimental Pharmacology, 183, 71-86. https://doi.org/10.1007/978-3-540-72167-3_4
Jiang, L., Berraondo, P., Jericó, D., Guey, L. T., Sampedro, A., Frassetto, A., Benenato, K. E., Burke, K., Santamaría, E., Alegre, M., Pejenaute, A., Kalariya, M., Butcher, W., Park, J. S., Zhu, X., Sabnis, S., Kumarasinghe, E. S., Salerno, T., Kenney, M.,... y Fontanellas, A. (2018). Systemic messenger rna as an etiological treatment for acute intermittent porphyria. Nature Medicine, 24(12), 1899-1909. https://doi.org/10.1038/s41591-018-0199-z
Jirikowski, G. F., Sanna, P. P., Maciejewski-Lenoir, D. y Bloom, F. E. (1992). Reversal of diabetes insipidus in Brattleboro rats: intrahypothalamic injection of vasopressin mrna. Science, 255(5047), 996-998. https://doi.org/10.1126/science.1546298
Kallen, K.-J. y Theß, A. (2014). A development that may evolve into a revolution in medicine: mrna as the basis for novel, nucleotide-based vaccines and drugs. Therapeutic Advances in Vaccines and Immunotherapy 2(1), 10-31. https://doi.org/10.1177/2051013613508729
Karikó, K., Ni, H., Capodici, J., Lamphier, M. y Weissman, D. (2004). mrna is an endogenous ligand for Toll-like receptor 3. Journal of Biological Chemistry, 279(13), 12542-12550. https://doi.org/10.1074/jbc.m310175200
Karikó, K., Buckstein, M., Ni, H. y Weissman, D. (2005). Suppression of rna recognition by Tolllike receptors: The impact of nucleoside modification and the evolutionary origin of rna. Immunity, 23(2), 165-175. https://doi.org/10.1016/j.immuni.2005.06.008
Karikó, K., Muramatsu, H., Keller, J. M. y Weissman, D. (2012). Increased erythropoiesis in mice injected with submicrogram quantities of pseudouridine-containing mrna encoding erythropoietin. Molecular Therapy, 20(5), 948-953. https://doi.org/10.1038/mt.2012.7
Koido, S., Kashiwaba, M., Chen, D., Gendler, S., Kufe, D. y Gong, J. (2000). Induction of antitumor immunity by vaccination of dendritic cells transfected with muc1 rna. The Journal of Immunology, 165, 5713-5719. https://doi.org/10.4049/jimmunol.165.10.5713
Lamb, Y. N. (2021). bnt162b2 mrna covid-19 vaccine: first approval. Drugs, 81, 495-501. https://doi.org/10.1007/s40265-021-01480-7
Levy, O., Zhao, W., Mortensen, L. J., Leblanc, S., Tsang, K., Fu, M., Phillips, J. A., Sagar, V., Anandakumaran, P., Ngai, J., Cui, C. H., Eimon, P., Angel, M., Lin, C. P., Yanik, M. F. y Karp, J. M. (2013). mrna-engineered mesenchymal stem cells for targeted delivery of interleukin-10 to sites of inflammation. Blood, 122(14), e23-e32. https://doi.org/10.1182/blood-2013-04-495119
Luo, F., Zheng, L., Hu, Y., Liu, S., Wang, Y., Xiong, Z., Hu, X. y Tan, F. (2017). Induction of protective immunity against Toxoplasma gondii in mice by ucleoside triphosphate hydrolase-ii (ntpase-ii) self-amplifying rna vaccine encapsulated in lipid nanoparticle (lnp). Frontiers in Microbiology, 8, 605. https://doi.org/10.3389/fmicb.2017.00605
Mahase, E. (2020). covid-19: Moderna applies for us and eu approval as vaccine trial reports 94.1% efficacy. bml, 371, m4709. https://doi.org/10.1136/bmj.m4709
Mallory, K. L., Taylor, J. A., Zou, X., Waghela, I. N., Schneider, C. G., Sibilo, M. Q., Punde, N. M., Perazzo, L. C., Savransky, T., Sedegah, M., Dutta, S., Janse, C. J., Pardi, N., Lin, P. J. C., Tam, Y. K., Weissman, D. y Angov, E. (2021). Messenger rna expressing Pfcsp induces functional, protective immune responses against malaria in mice. npj Vaccines, 6(84), 1-12. https://doi.org/10.1038/s41541-021-00345-0
Mays, L. E., Ammon-Treiber, S., Mothes, B., Alkhaled, M., Rottenberger, J., Müller-Hermelink, E. S., Grimm, M., Mezger, M., Beer-Hammer, S., Von Stebut, E., Rieber, N., Nürnberg, B., Schwab, M., Handgretinger, R., Idzko, M., Hartl, D. y Kormann, M. S. (2013). Modified Foxp3 mrna protects against asthma through an il-10-dependent mechanism. The Journal of Clinical Investigation, 123(3), 1216-1228. https://doi.org/10.1172/jci65351
Medina-Magües, L. G., Gergen, J., Jasny, E., Petsch, B., Lopera-Madrid, J., Medina-Magües, E. S., Salas-Quinchucua, C. y Osorio, J. E. (2021). mrna vaccine rotects against Zika virus. Vaccines, 9(12), 1464. https://doi.org/10.3390/vaccines9121464
Meyer, M., Huang, E., Yuzhakov, O., Ramanathan, P., Ciaramella, G. y Bukreyev, A. (2018). Modified mrna-based vaccines elicit robust immune responses and protect Guinea pigs from Ebola virus disease. The Journal of Infectious Diseases, 217(3), 451-455. https://doi.org/10.1093/infdis/jix592
Okumura, K., Nakase, M., Inui, M., Nakamura, S., Watanabe, Y. y Tagawa, T. (2008). Bax mrna therapy using cationic liposomes for human malignant melanoma. The Journal of Gene Medicine, 10(8), 910-917. https://doi.org/10.1002/jgm.1214
Pollard, C., Rejman, J., De Haes, W., Verrier, B., Van Gulck, E., Naessens, T., De Smedt, S., Bogaert, P., Grooten, J., Vanham, G. y De Koker, S. (2013). Type I ifn counteracts the induction of antigen-specific immune responses by lipid-based delivery of mrna vaccines. Molecular Therapy, 21(1), 251-259. https://doi.org/10.1038/mt.2012.202
Robinson, E., MacDonald, K. D., Slaughter, K., McKinney, M., Patel, S., Sun, C. y Sahay, G. (2018). Lipid nanoparticle-delivered chemically modified mifn restores chloride secretion in cystic fibrosis. Molecular Therapy, 26(8), 2034-2046. https://doi.org/10.1016/j.ymthe.2018.05.014
Sahin, U., Karikó, K. y Türeci, Ö. (2014). mrna-based therapeutics: developing a new class of drugs. Nature Reviews Drug Discovery, 13(10), 759-780. https://doi.org/10.1038/nrd4278
Wang, Y., Zhang, Z., Luo, J., Han, X., Wei, Y. y Wei, X. (2021). mrna vaccine: a potential therapeutic strategy. Molecular Cancer, 20, 33. https://doi.org/10.1186/s12943-021-01311-z
Weissman, D. (2015). mrna transcript therapy. Expert Review of Vaccines, 14(2), 265-281. https://doi.org/10.1586/14760584.2015.973859
Weng, Y., Li, C., Yang, T., Hu, B., Zhang, M., Guo, S., Xiao, H., Liang, X. J. y Huang, Y. (2020). The challenge and prospect of mrna therapeutics landscape. Biotechnology Advances, 40, 107534. https://doi.org/10.1016/j.biotechadv.2020.107534
Wolff, J. A., Malone, R. W., Williams, P., Chong, W., Acsadi, G., Jani, A. y Felgner, P. L. (1990). Direct gene transfer into mouse muscle in vivo. Science, 247(4949 pt. 1), 1465-1468. https://doi.org/10.1126/science.1690918
Zangi, L., Lui, K. O., Von Gise, A., Ma, Q., Ebina, W., Ptaszek, L. M., Später, D., Xu, H., Tabebordbar, M., Gorbatov, R., Sena, B., Nahrendorf, M., Briscoe, D. M., Li, R. A., Wagers, A. J., Rossi, D. J., Pu, W. T. y Chien, K. R. (2013). Modified mrna directs the fate of heart progenitor cells and induces vascular regeneration after myocardial infarction. Nature Biotechnology, 31(10), 898-907. https://doi.org/10.1038/nbt.2682
Zimmermann, O., Homann, J. M., Bangert, A., Müller, A. M., Hristov, G., Goeser, S., Wiehe, J. M., Zittrich, S., Rottbauer, W., Torzewski, J., Pfitzer, G., Katus, H. A. y Kaya, Z. (2012). Successful use of mrna-nucleofection for overexpression of interleukin-10 in murine monocytes/macrophages for anti-inflammatory therapy in a murine model of autoimmune myocarditis. Journal of the American Heart Association, 1(6), e003293. https://doi.org/10.1161/jaha.112.003293


