El radical CIO y la capa de ozono
Rodrigo Morales Cueto
Profesor e investigador, Centro de Investigaciones Químicas (CIQ), UAEM
Dar por cierto un conocimiento implica confiar en que el interlocutor o quien escribe está afirmando algo lógico, veraz y que deja muy pocas dudas respecto a lo que se conoce. El camino que recorre el conocimiento científico para ser reconocido es largo, tortuoso y lleva consigo el peligro de morir víctima del descrédito entre los protagonistas de la ciencia establecida. Esto se debe a que el conocimiento científico se sustenta en pruebas que confirman que este no se contradice con lo afirmado; pero, paradójicamente, cuando esto se desafía se da un progreso tangible; es decir, cuando hay un cambio de paradigma.
Así pues, la savia que nutre los frutos de las ramas del gran árbol de la ciencia proviene de las inamovibles raíces del conocimiento establecido por muchos experimentos que no lo pueden contradecir. En estas líneas se presenta el recuento de algunos hallazgos científicos del siglo XX que redundaron en el descubrimiento del llamado “agujero de la capa de ozono”, cuyo descubrimiento motivó el establecimiento del Protocolo de Montreal, enfocado en la recuperación de los niveles de ozono naturales en la estratósfera de la Antártida, mediante la prohibición del uso de clorofluorocarburos en el mundo.
La interacción radiación-materia es un fenómeno que da cuenta del comportamiento cuántico de la naturaleza de la materia y la energía, y que sentó los precedentes teóricos de la tecnología láser desarrollada en el siglo XX. Albert Einstein, al dar explicación al experimento del efecto fotoeléctrico, demostró que la cinética de absorción y emisión espontánea podían ser explicadas teóricamente teniendo en cuenta únicamente los niveles energéticos disponibles de los átomos involucrados y su población.1
Asimismo, este célebre científico predijo la existencia de la emisión estimulada, en la que una partícula excitada decaería a un estado basal ante la presencia de radiación que coincidiera energéticamente con su exceso. Esta radiación estimulada, adicionalmente de la frecuencia, conserva la fase y la dirección de la radiación que la induce. La emisión estimulada predicha fue confirmada en los años cuarenta por Willis E. Lamb y R. C. Retherford, al explicar transiciones vibroelectrónicas específicas del espectro de emisión del hidrógeno.
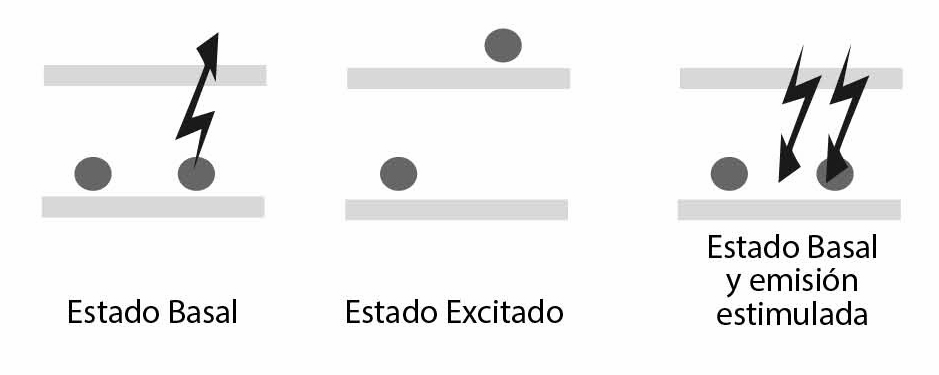
En los años cincuenta, Townes y sus estudiantes de posgrado construyeron el primer emisor de microondas de forma estimulada, llamado MASER (Microwave Amplification by Stimulated Emission of Radiation). En los años siguientes, Townes trabajó en el desarrollo de un sistema de producción de radiación estimulada en la región del infrarrojo de forma amplificada y lo comentó con el entonces estudiante doctoral de la Universidad de Columbia, Gordon Gould, quien algunos años después, en una conferencia, acuñaría el término LASER (Light Amplification by Stimulated Emission of Radiation), y quien disputaría su patente con Bell Labs durante dos décadas. Gordon Gould, finalmente, fue beneficiado por la invención del láser por descarga eléctrica y por bombeo óptico en 1987.
Paralelamente al desarrollo tecnológico del láser con base en conocimientos científicos sólidos, lord George Porter perfeccionaba la técnica flash photolysis con el fin de crear especies químicas transitorias, llamadas radicales, por medio de destellos de luz, y de tomar datos espectroscópicos durante su lábil existencia. Fue así que pudo determinar la cinética de segundo orden de un radical que solo una década antes ni siquiera se pensaba que pudiera medirse, por la brevedad de su tiempo de vida: el radical monóxido de cloro (ClO).
Cl2 + hn → 2Cl
2Cl + O2 → 2ClO
2ClO → Cl2 + O2
La cinética de esta reacción demostró que entre las dos primeras etapas de generación del radical y el fin de la cadena existía una serie de reacciones intermediarias, entre ellas, la posible generación del dímero ClOOCl.
Cl + O2 → ClOO
ClOO +Cl → 2ClO
2ClO → ClOOCl
ClOOCl → Cl2 + O2
La investigación de George Porter tenía un interés meramente espectroscópico: era el primer radical medido por observación directa y en tiempo real (milisegundos), y fue publicada en 1950.2 Apenas en 1947, durante el foro organizado por The Royal Chemical Society, denominado “The Labile Molecule” y publicado en Discussion Faraday Society, no se hizo referencia alguna a la utilización de pulsos de luz. H. W. Mellville menciona en las memorias del foro que las especies químicas intermedias en una reacción podrían vivir mil veces menos que un segundo, por lo que “nunca se podrán medir”. En los años siguientes, diversos grupos de investigación abundaron sobre la forma de obtener este radical y sobre la interacción del intermediario con otros compuestos presentes en la celda, como el ozono y los óxidos de nitrógeno. Asimismo, se empezó a utilizar el láser de rubidio como fuente de radiación para obtener los intermediarios y medir el tiempo de existencia de los radicales. Se sospechó, entonces, que podría haber una reacción del radical cloro con moléculas de ozono, dejando moléculas diatómicas de oxígeno con exceso de energía vibracional (reactivas), y la misma reacción con moléculas de radical ClO (reactivas).
O + ClO2 → ClO + O2*
Cl + O3 → ClO* + O2
Una fuente ubicua de radicales con base en el cloro son los clorofluorocarburos, que habían sido comercializados por la empresa Dupont en los años veinte como propelentes de aerosoles refrigerantes, en sustitución del peligroso amoniaco, y como agentes activos para la extinción de fuego, debido a que contaban con propiedades muy deseables: eran inertes, más pesados que el aire y presentaban una alta capacidad calorífica. En 1970, James Lovelock midió concentraciones de estos compuestos, originados exclusivamente por el ser humano, en sitios tan remotos como la Antártida.
Para 1974, Sherwood Rowland y Mario Molina postularon que, debido a la forma natural de mezclado por convección en la atmósfera, estos compuestos podrían llegar a la estratósfera, ser irradiados por mayor cantidad de fotones ultravioleta (UV) y destruir, por la cadena de reacción de radicales, la capa de ozono.3 La reacción entre el radical Cl y el ozono es factible, pero la deposición del dímero ClOOCl sobre cristales de hielo estratosférico durante el invierno austral y la súbita liberación al ser irradiados por luz UV aumenta la velocidad a magnitudes mucho mayores que la correspondiente a si esta ocurriera solamente en estado gaseoso.
Algunos años después el pronóstico no solo se había cumplido, sino que se comprobó que se había subestimado. En 1984, Joseph Farman observó por primera vez el adelgazamiento de la capa de ozono durante algunas semanas de la primavera austral, al medir una alta incidencia de radiación UV en la Antártida.4 Más tarde, James Anderson midió la concentración del radical ClO estratosférico, en tanto que M. H. Proffit y W. L. Starr midieron la concentración de ozono durante la misma misión científica aérea en la Antártida y dieron a conocer la anticorrelación entre la concentración del radical y la disminución del ozono. El llamado “agujero de la capa de ozono” quedaba así empíricamente comprobado.
Figura 1. Concentración del radical CIO y del ozono fuera del vórtice antártico
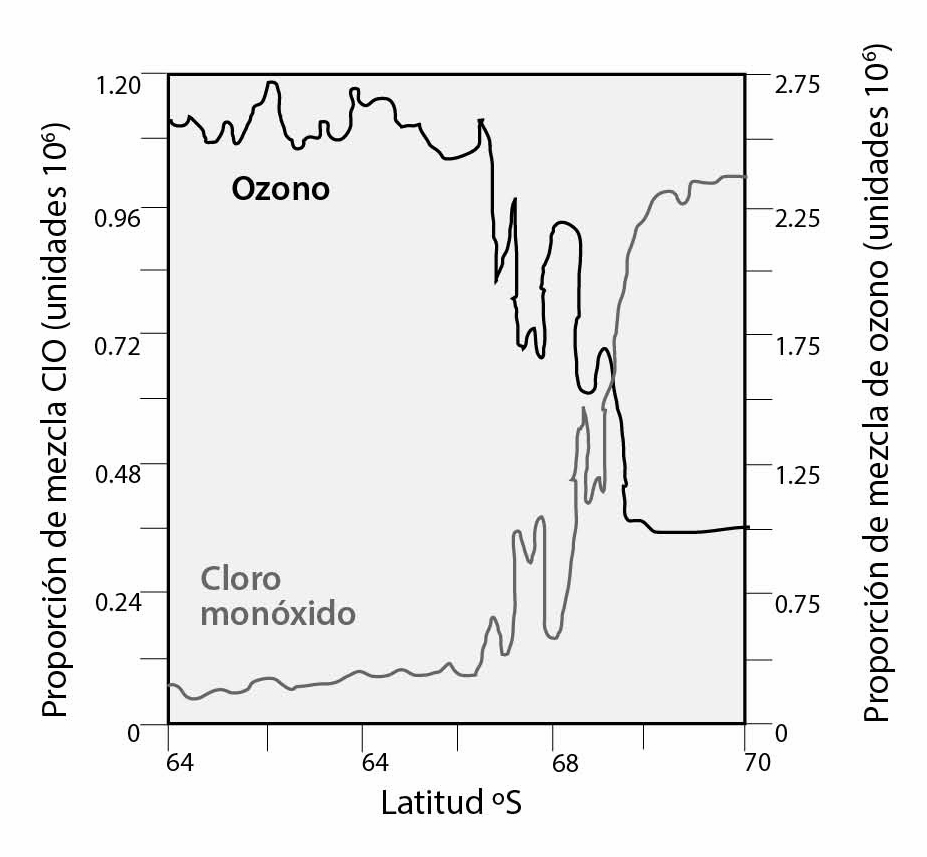
En la figura 1 se muestra la concentración del radical ClO y del ozono fuera del vórtice antártico. Del lado izquierdo, la concentración de ozono es alta y la del radical baja, caso contrario al entrar en el vórtice, a 68° S, donde la concentración de ozono decrece en tanto que la del radical ClO aumenta.5 Así, el interés por estudiar una especie química transitoria cuyas herramientas de medición espectroscópicas (pulsos de luz) ni siquiera se vislumbraban en foros especializados algunos años antes, resultó ser la especie química responsable de uno de los fenómenos causados por actividades humanas de mayor alcance global.
La relación causa-efecto (aumento de concentración de ClO-disminución de capa de ozono) originó el primer acuerdo internacional para prohibir la producción y el uso de los clorofluoro-carburos en todos los países que suscribieran el Protocolo de Montreal, gestado entre 1987 y 1989, el cual ha tenido distintas modificaciones y ha involucrado a casi doscientos países, elevando así su grado a ratificación universal en 2009.6 Actualmente es reconocido como el parangón de colaboración internacional, en aras de tomar medidas para remediar un desastre de escala global, a raíz de investigaciones científicas sin aplicación “práctica” aparente.
Notas
1 Albert Einstein, “Strahlungs-emission und-absorption nach der quantentheorie”, Verhandlungen der Deutschen Physikalischen Gesellschaft, vol. 18, 1916, pp. 318-323
2 “Porter, Proc. . Roy. Soc. A, 1950, 200, 284.
3 Mario J. Molina y F. S. Rowland, “Stratospheric sink for chlorofluoromethanes: clorine atom-catalysed destruction of ozone”, Nature, vol. 249, núm. 5460, 1974, pp. 810-812.
4 Joseph Charles Farman, Brian G. Gardines y Jon D. Shanklin, “Large losses of total ozone in Antarctica reveal seasonal ClOx/NOx interaction”, Nature, vol. 315, 1985, pp. 207-210.
5 James G. Anderson, William H. Brune y Michael H. Proffitt, “Ozone destruction by chlorine radicals within the Antarctic vortex: the spatial and temporal evolution of ClO–O3 anticorrelation based on in situ ER-2 data”, Journal of Geophysical Research, vol. 94, 1989, pp. 11465-11479.
6 Ozone Secretariat, http://ozone.unep.org
*Energía vibracional en exceso de 250 kJ/mol.