Enfoque molecular del envenenamiento por plomo
Jorge Iván Amaro-Estrada *
César Iván León Pimentel *
Humberto Saint-Martín *
Alejandro Ramírez-Solís **
Debido a sus propiedades de maleabilidad, que es la capacidad de extenderse en láminas delgadas, y ductilidad, que es la de soportar grandes deformaciones en frío sin llegar a romperse, así como de resistencia a la corrosión y bajo punto de fusión, entre otras, el plomo (Pb) ha sido un metal ampliamente utilizado en la industria, especialmente en la fabricación de objetos de uso cotidiano, como tuberías de agua, monedas, cerámicos, vidrios, pigmentos y cosméticos. El uso del plomo no se restringe únicamente a la época moderna; existen registros de piezas fabricadas con este elemento que datan de las civilizaciones establecidas en Egipto, Mesopotamia, Persia y Roma.1 Un ejemplo de esto es la extracción de piezas de acueductos de la época del imperio romano, las cuales sugieren que su sistema de distribución de agua estaba basado en tuberías construidas con plomo.
Este elemento metálico se presenta de forma natural en la corteza terrestre, principalmente en depósitos subterráneos en forma de minerales, denominados galena (PbS) y cerusita (PbCO3). Además de su carácter natural, existen fuentes de contaminación antropogénicas que han aumentado considerablemente la cantidad de plomo en el medio ambiente. En 1920, la introducción en el mercado mundial del compuesto tetraetilo de plomo (tep) (CH3CH2)4Pb como un aditivo barato para la gasolina aumentó radicalmente los niveles de contaminación por este elemento.
En términos generales, el tep actúa como un agente antidetonante, es decir, evita que ocurra un encendido instantáneo y difuso del combustible antes de tiempo, lo que permite obtener una explosión controlada en los cilindros y un mayor rendimiento del motor. En 1976, después de cincuenta años de uso del tep, la agencia de protección del medio ambiente de Estados Unidos puso en marcha el programa de disminución gradual de la fabricación de gasolinas que contenían este compuesto contaminante y, al mismo tiempo, inició el proceso de regulación del contenido de plomo en otros productos comerciales. Años más tarde, algunos países intentaron implementar esta estrategia.
En este sentido, en México se eliminó por completo el uso de gasolina con plomo en 1997.2 Sin embargo, a pesar del esfuerzo por erradicar el uso de plomo en procesos industriales y de producción de gasolinas, de acuerdo con la Organización Mundial de la Salud (oms), en la actualidad se sigue teniendo una exposición significativa a este elemento, la cual ocurre principalmente a través de dos vías:
- La inhalación de partículas generadas en el proceso de combustión de materiales que contienen este metal, lo cual ocurre, por ejemplo, en actividades de fundición, reciclaje en condiciones no seguras o durante el uso de gasolina con plomo.
- La ingestión de polvo, agua o alimentos contaminados, la cual se produce al canalizar agua por medio de tuberías construidas con plomo o mediante el consumo de alimentos envasados en recipientes que contienen esmalte de plomo o han sido soldados con este metal.3
En particular, en México los principales factores de riesgo son la exposición al tráfico vehicular, el uso de loza vidriada —principalmente utensilios de barro—, el tabaquismo y, en los niños, a través del patrón de ingestión de materiales no comestibles, conocido como pica.4
Sin duda, la contaminación por plomo es un problema muy importante debido a los efectos nocivos que ocasiona en la salud de los seres humanos, los cuales han sido documentados desde la antigüedad. Se tiene registro de que en la cultura romana, la aristocracia sufría de migraña, insomnio, cólicos y constipación, todos ellos síntomas tempranos de envenenamiento por plomo —también conocido como saturnismo—, causados por el exceso en la ingesta de vino endulzado con azúcar de plomo (acetato de plomo).5
Pero el problema está lejos de ser una cuestión del pasado. En 2004 se reportó que los niveles de plomo en el agua de consumo doméstico en Washington dc superaban los límites permitidos por la Agencia de Protección Ambiental de Estados Unidos (epa);6 inclusive se emitió la recomendación de que los residentes de hogares con líneas de agua antiguas —presumiblemente fabricadas con plomo— dejaran correr el agua del grifo durante alrededor de un minuto antes de utilizarla para beber o cocinar. Pero el caso no es aislado y se estima que hoy en día, alrededor de 11.5 millones de consumidores de agua en Estados Unidos reciben agua potable con alto contenido de plomo.7
Actualmente se reconoce que el nivel de plomo en la sangre de un individuo no debe rebasar los 10 μg/dl —es decir, 0.0001 gramos de plomo por cada litro de sangre—,8 ya que los altos niveles de plomo en el torrente sanguíneo están relacionados con impedimentos cognitivos, reducción del coeficiente intelectual, problemas cardiovasculares, bajo peso al nacer, esperanza de vida disminuida y, posiblemente, aumento en la tasa de crímenes violentos.9
Se estima que en 2012 se produjeron alrededor de 10.5 millones de toneladas de este metal en el mundo, siendo México el sexto mayor productor, con aproximadamente 334 mil toneladas.10
Por todo lo anterior, entender el fenómeno del envenenamiento por plomo desde un nivel molecular puede contribuir de manera sustancial al tratamiento de este problema.
Análisis molecular
En solución acuosa, el plomo se oxida por la acción del oxígeno del agua, perdiendo dos electrones para formar el ion Pb2+.
Pb(sólido) → Pb2+(solución)+2e-
Los electrones se consumen en el medio acuoso formando iones hidroxilo (OH-), así como iones hidronio (H3O+).11 Como un caso particular, podemos considerar una solución diluida de tep, la cual se descompone y produce una sal de trietilo, después otra de dietilo y, finalmente, Pb2+.12
R4Pb→ R3Pb+ →R2Pb2+ →Pb2+
Se sabe que Pb2+ tiene como blancos moleculares dos clases de proteínas: las que se enlazan de manera natural con cinc (Zn) y las que se enlazan con calcio (Ca);13 como ejemplo podemos mencionar la sinaptotagmina, que actúa como un sensor de calcio en los neurotransmisores (figuras 1a y 1b).
El mecanismo mediante el cual el Pb2+ se introduce en el interior de la célula aún se desconoce; sin embargo, el estudio de las propiedades enlazantes de este metal con su ambiente de agua es fundamental para entender la interacción de este elemento con los canales que permiten el paso selectivo de iones específicos a través de la membrana celular. Diversos estudios reportan que dicho paso está directamente relacionado con el tipo de hidratación que presenta,14 es decir, la forma en que las moléculas de agua se ordenan alrededor del ion de plomo.
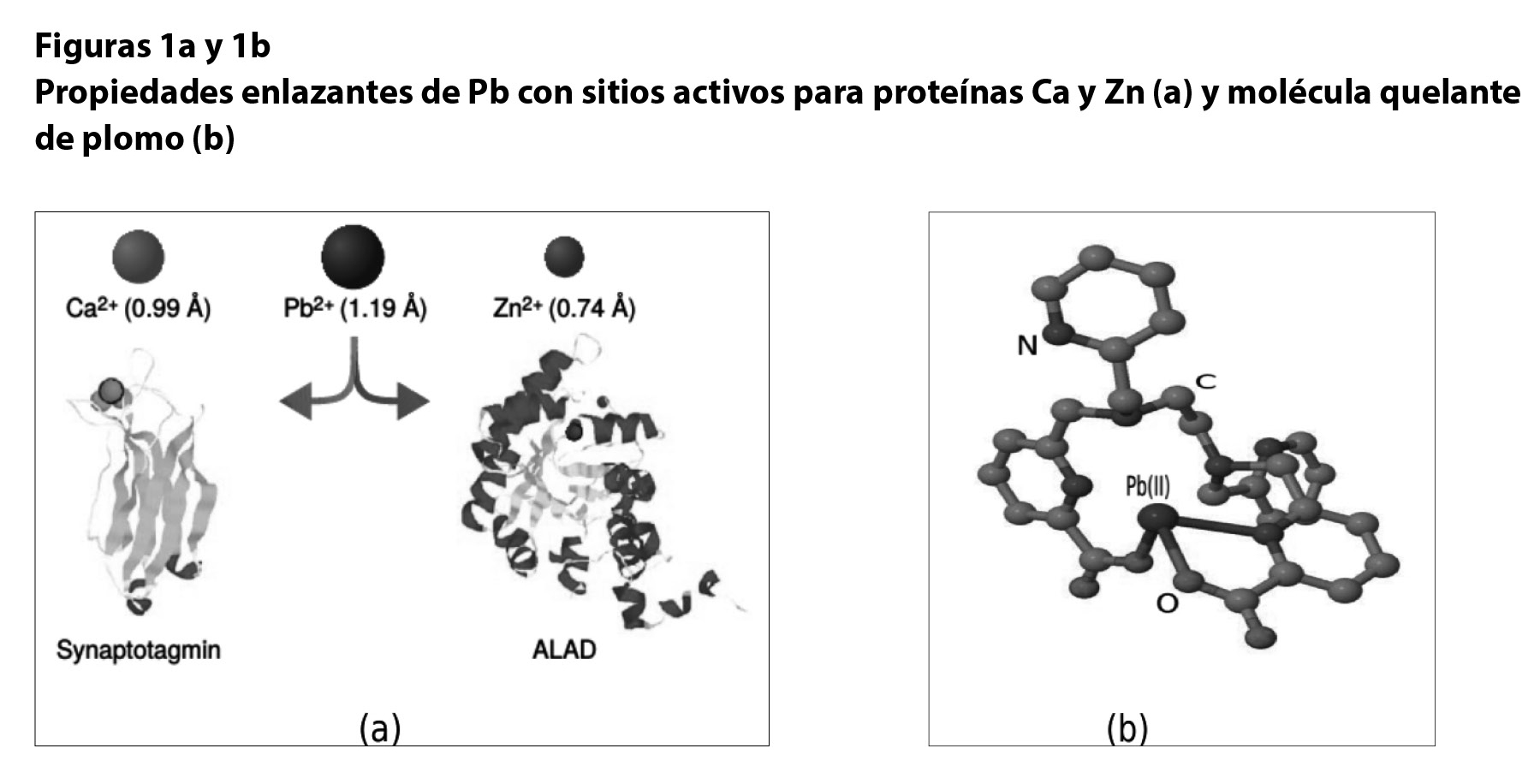
Por otra parte, una vez que Pb2+ ha ingresado en el organismo, la solución más común para evitar el envenenamiento es la terapia por medio de agentes quelantes, los cuales son moléculas que forman complejos con iones de metales tóxicos (figura 1b). Estos complejos son químicamente inactivos, por lo que ya no representan un peligro, además de que se pueden desechar mediante la orina. El problema con este tipo de tratamiento es que los quelantes más comunes, como el ácido etilendiaminotetraacético —comúnmente conocido como edta—, no son altamente selectivos, lo cual quiere decir que, además del plomo, extraen iones importantes para el funcionamiento adecuado del organismo, como el calcio, el hierro y el cinc. Lo anterior tiene como consecuencia padecimientos como la hipocalcemia —nivel de calcio en la sangre inferior al normal—, entre otras.
Por otra parte, el estudio experimental en laboratorio del Pb2+ en solución acuosa conlleva un alto grado de dificultad, debido principalmente a que Pb es un elemento capaz de apantallar los rayos-X. Esto impide utilizar las técnicas estándar de la espectroscopía, por lo cual es necesario emplear técnicas más refinadas, como la estructura fina por absorción extendida de rayos-X (exafs, por sus siglas en inglés).15 Con esta técnica es posible conocer detalles sobre la química de coordinación de soluciones acuosas; sin embargo, los datos obtenidos necesitan ser interpretados mediante un modelo matemático. Por lo anterior, el estudio de la hidratación de iones pesados como el Pb2+ con métodos teóricos es de gran importancia.
En este sentido, hemos realizado una investigación teórica mediante simulaciones por computadora conocidas como de dinámica molecular de primeros principios,16 para indagar las propiedades energéticas y estructurales del ion Pb2+ en solución acuosa. Para ello estudiamos agregados de Pb2+ interactuando con 6, 8, 12 y 29 moléculas de agua.
En la figura 2 se muestran las funciones de distribución radial (rdf, por sus siglas en inglés) obtenidas a partir de las simulaciones. En términos generales, la rdf describe el cambio en la densidad del medio como función de la distancia a un átomo de referencia. En este caso particular, nos interesa describir qué tan probable es encontrar un átomo de oxígeno —y por lo tanto, una molécula de agua— a una distancia r del plomo. Es posible observar (figura 2) que para el cúmulo [Pb(H2O)n]2+ con n=6, la probabilidad de encontrar un átomo de oxígeno a una distancia de 3.5 Å es prácticamente nula, mientras que para el caso n=29, la probabilidad a esta misma distancia es considerablemente mayor.
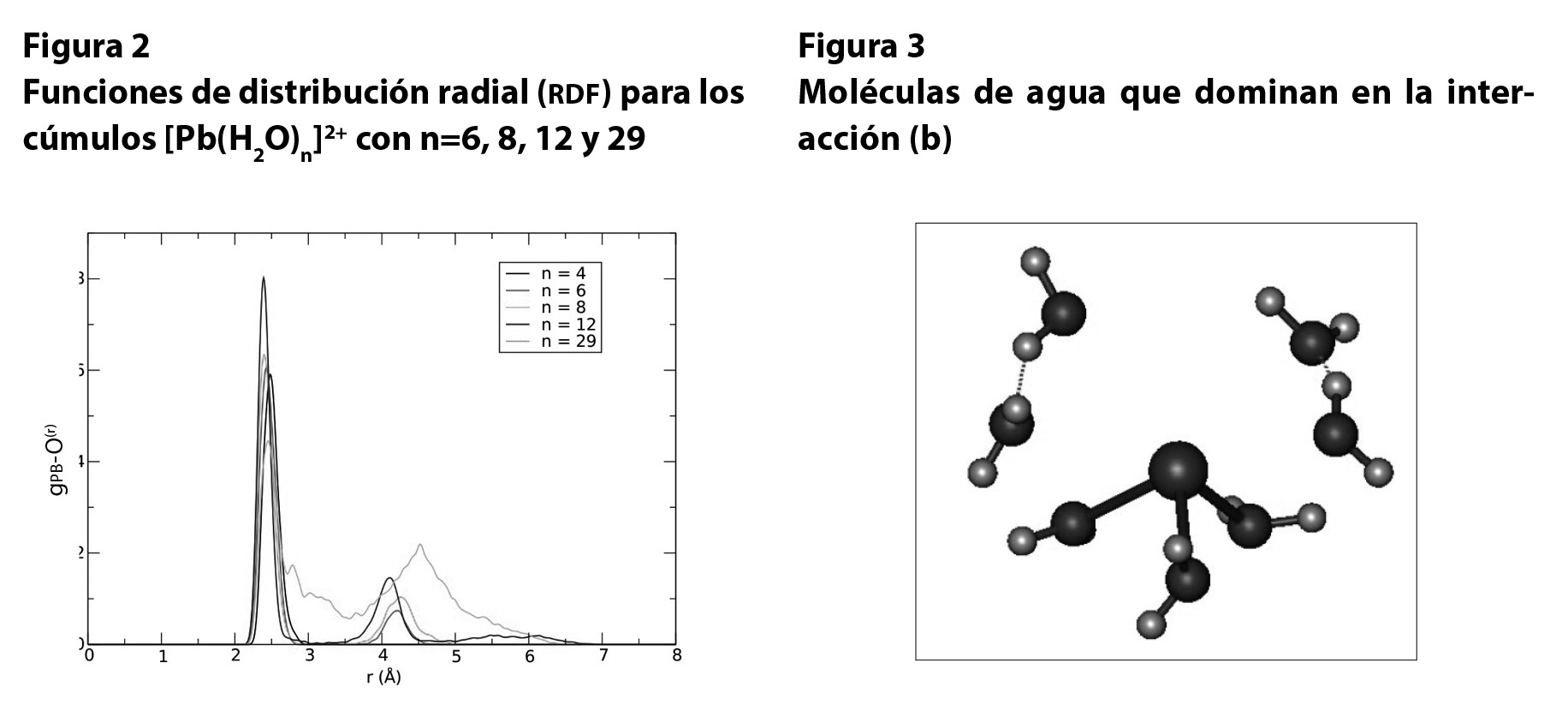
Lo anterior nos indica que el cúmulo [Pb(H2O)6]2+ tiene una estructura bien definida, en la cual cuatro moléculas de H2O interactúan directamente con el ion Pb2+ y otras dos moléculas lo hacen de forma indirecta, con una baja probabilidad de acercarse y reemplazar alguna de las moléculas de agua más cercanas. En el caso n=29, la estructura no está tan bien definida y existe la posibilidad de que moléculas de agua inicialmente alejadas se acerquen e interactúen directamente con el ion.
Mediante el análisis de las rdf y de la evolución temporal de las distancias Pb-O se concluye que el Pb2+ presenta un número de coordinación de 6.5, lo que significa que muestra una interacción directa con las tres aguas más cercanas e indirecta con las siguientes cuatro más próximas. Es decir, las cuatro moléculas de agua menos ligadas tienen más libertad de movimiento, de modo que en promedio temporal no hay siete, sino sólo 6.5 aguas cercanas. Esta información es relevante, ya que otros iones, como el Ca2+, tienen interacción directa con ocho moléculas de agua y, de esta forma, se pueden proponer teóricamente bloques moleculares que sean selectivos y permitan remover únicamente el Pb2+, en lugar de iones vitales, para el buen funcionamiento del cuerpo humano.
Se pretende que través de los resultados de ésta y otras investigaciones en curso sea posible desarrollar conocimiento que conduzca a la creación de productos y servicios novedosos que contribuyan a resolver, de manera sustantiva y sustentable, el problema de la contaminación del agua por metales y metaloides.
* Instituto de Ciencias Físicas, Universidad Nacional Autónoma de México (unam)
** Centro de Investigación en Ciencias (cic), uaem
Notas
1 Jerome O. Nriagu, Lead and lead poisoning in antiquity, John Wiley & Sons, Nueva York, 1982.
2 Alice Hamilton, Paul Reznikoff y Grace M. Burnham, “Tetraetilo de plomo”, Salud Pública de México, vol. 35, núm. 5, 1993, pp. 520-533.
3 “Intoxicación por plomo y salud”, oms, 2016, https://goo.gl/5vxHFW, consultado en octubre de 2016.
4 Isabelle Romieu, Eduardo Palazuelos, Mauricio Hernández-Ávila, Camilo Ríos, Ilda Muñoz-Quiles, Carlos Jiménez Gutiérrez et al., “Sources of lead exposure in Mexico City”, Environmental Health Perspectives, 1994, vol. 4, pp. 384-389; Mauricio HernándezÁvila, Isabelle Romieu, Camilo Ríos, Araceli Rivero y Eduardo Palazuelos, “Lead-glazed ceramics as major determinants of blood lead levels in Mexican women”, Environmental Health Perspectives, vol. 94, 1991, pp. 117-120.
5 Jerome O. Nriagu, “Saturnine gout among roman aristocrats”, The New England Journal of Medicine, vol. 308, núm. 11, 1983, pp. 660-663.
6 David Nakamura, “Water in dc exceeds epa lead limit”, The Washington Post, 30 de enero de 2004, p. A01, https://goo.gl/0HaiqP, consultado en octubre de 2016.
7 Yanna Lambrinidou y Marc Edwards, “Five myths about lead in water”, The Washington Post, 26 de febrero de 2016, https://goo.gl/u8m7Mg, consultado en octubre de 2016.
8 Preventing lead poisoning in young children: a statement by the Centers for Disease Control and Prevention, cdc, Atlanta, 1991.
9 David M. Fergusson, Joseph M. Boden, L. John Horwood, “Dentine lead levels in childhood and criminal behavior in late adolescence and early adulthood”, Journal of Epidemiology and Community Health, vol. 62, núm. 12, 2008, pp. 1045-1050.
10 “Lead production and statistics”, International Lead Association, https://goo.gl/yCJ3DE, consultado en octubre de 2016.
11 José S. Casas y José Sordo (eds.), Lead: chemistry, analytical aspects. Environmental impact and health effects, Elsevier, Amsterdam, 2007.
12 Karel Verschueren, Handbook of environmental data on organic chemicals, John Wiley & Sons, 2ª ed., Nueva York, 1983.
13 Hilary A. Godwin, “The biological chemistry of lead”, Current Opinion in Chemical Biology, vol. 5, 2001, pp. 223-227.
14 Yufeng Zhou, Joao H. Morais-Cabral, Amelia Kaufman y Roderick MacKinnon, “Chemistry of ion coordination and hydration revealed by a K+ channel-Fab complex at 2.0 A resolution”, Nature, vol. 414, núm. 6859, 2001, pp. 43-48.
15 John J. Rehr y Robert C. Albers, “Theoretical approaches to X-ray absorption fine structure”, Reviews of Modern Physics, vol. 72, 2000, pp. 621-654.
16 Jorge Iván Amaro-Estrada, César Iván León Pimentel, Humberto Saint-Martin, Alejandro Ramírez-Solís, “Born-Oppenheimer molecular dynamics studies of the hydration of Pb(ii)”, submitted to Physical Chemistry Chemical Physics.