Degradación de colorantes en aguas residuales mediante oxidación
Esteban Montiel Palacios •
Josefina Vergara Sánchez •
César Torres Segundo •
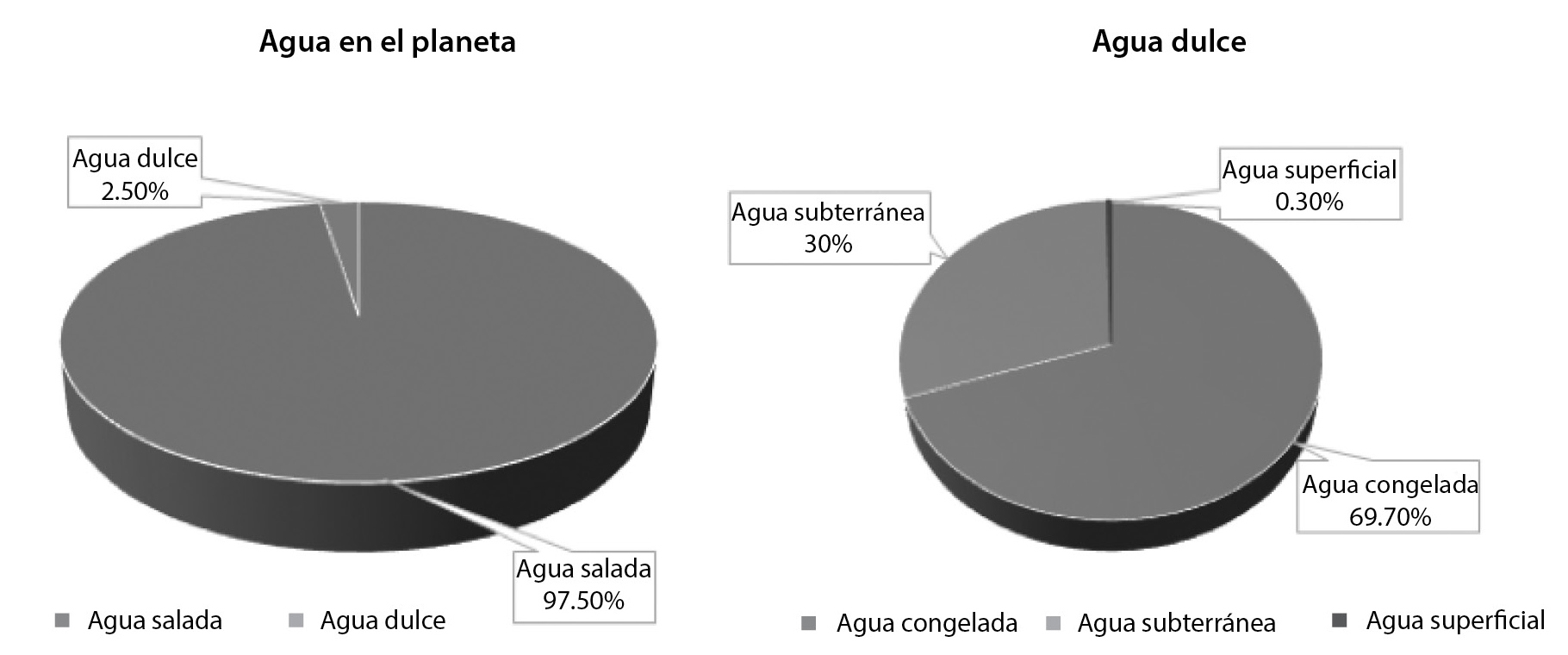
El agua es un recurso natural renovable, pero renovar la calidad del agua residual es una tarea compleja. Se considera que, en todo el mundo, existe una disponibilidad promedio de agua de 1 386 millones de km3. De esta cantidad, sólo el 2.5% es agua dulce. De esos 35 millones de km3 de agua dulce, 24.4 millones de km3 forman parte de glaciares, hielo y nieve, 10.5 millones de km3 se encuentran en mantos acuíferos y únicamente un porcentaje menor al 0.30% se encuentra en ríos y lagos (figura 1).1
Se le llama agua dulce a aquella que tiene una baja concentración de sales minerales disueltas. Un litro tiene más o menos 0.1 g de sales disueltas, mientras que uno de agua salada puede contener entre 33 y 38 g de sal.2 En el siglo xx la población del mundo se triplicó, lo que significó un incremento en la presión sobre los recursos hídricos, lo cual ocasionó que la extracción de agua para consumo humano se sextuplicara.
A nivel mundial el agua extraída de fuentes superficiales y mantos acuíferos se destina principalmente a la agricultura (70%) y a la industria (19%). México se encuentra entre los diez países con mayor extracción de agua. En 2015 se extrajeron 85 800 hm3 de agua, de los cuales el 76.30% se empleó en la agricultura y 9.1% en la industria.
Morelos se encuentra en una región —hidrológica administrativa IV (Balsas)— donde el grado de presión sobre el recurso hídrico es alto. En este estado se extrajeron, en el año mencionado, 1 313.4 hm3 de agua, de los cuales el 75.1% se destinó al uso agrícola y el 3.6% al industrial.3
Las aguas residuales son aguas de composición variada provenientes de la descarga de usos municipales, industriales, comerciales, de servicios, agrícolas, pecuarios, domésticos y, en general, de cualquier otro uso, así como la mezcla de ellas.4
En 2014 se generaron en el estado 228.70 m3/s de aguas residuales municipales, de los cuales se recolectaron en alcantarillado 211 m3/s pero únicamente se trataron 111.30 m3/s. Esto significa que el 51.33% de las aguas residuales generadas son arrojadas sin tratamiento alguno en los cuerpos de agua, es decir, más de la mitad. Al año se producen 1.95 millones de toneladas de DBO5 (Demanda Bioquímica de Oxígeno, determinada después de cinco días de reacción), se recolectan en alcantarillado 1.80 y se tratan sólo 0.77 millones de toneladas, esto es, se arroja en los cuerpos de agua el 60.51% de la carga contaminante producida. En la figura 2 se muestra información sobre el gasto volumétrico y la carga contaminante en las aguas residuales municipales generadas durante 2014.
Figura 1
Disponibilidad de agua
Las aguas residuales municipales fueron tratadas en 2 337 plantas que operaron al 73.26% de su capacidad. El 0.40% de estas aguas fueron sometidas a tratamiento primario, el 99.40% a secundario y el 0.20% a terciario. El tratamiento primario fue efectuado mediante tanques Imhoff y tanques sépticos. En cuanto al tratamiento secundario, los mayores porcentajes fueron logrados mediante 709 plantas de lodos activados (59.50%) y 718 lagunas de estabilización (12.50%).5
En Morelos, en 2014 se contaba con 48 plantas para el tratamiento de las aguas municipales, las cuales tenían una capacidad instalada de 2.83 m3/s y operaban un caudal de 1.53 m3/s. Estas plantas trabajaban al 54.06% de su capacidad.6
En lo referente a aguas residuales industriales, ese mismo año se generaron 211.36 m3/s y se trataron 65.56 m3/s. El porcentaje de tratamiento de estas aguas fue sólo del 31.02%. Al año se generan 9.99 millones de toneladas de DBO5, de los cuales en los sistemas de tratamiento se remueven 1.39 millones de toneladas, es decir, se arrojan 8.6 millones de toneladas de DBO5 a los cuerpos de agua, lo que corresponde al 86.09% de la carga contaminante.7
Las plantas de tratamiento de aguas residuales industriales a nivel nacional tienen una capacidad instalada de 81.51 m3/s y un caudal tratado de 65.56 m3/s, es decir, operan al 80.43% de su capacidad.
Figura 2
Aguas residuales industriales a nivel nacional, gasto volumétrico (izquierda) y carga contaminante (derecha), datos reportados en 2014

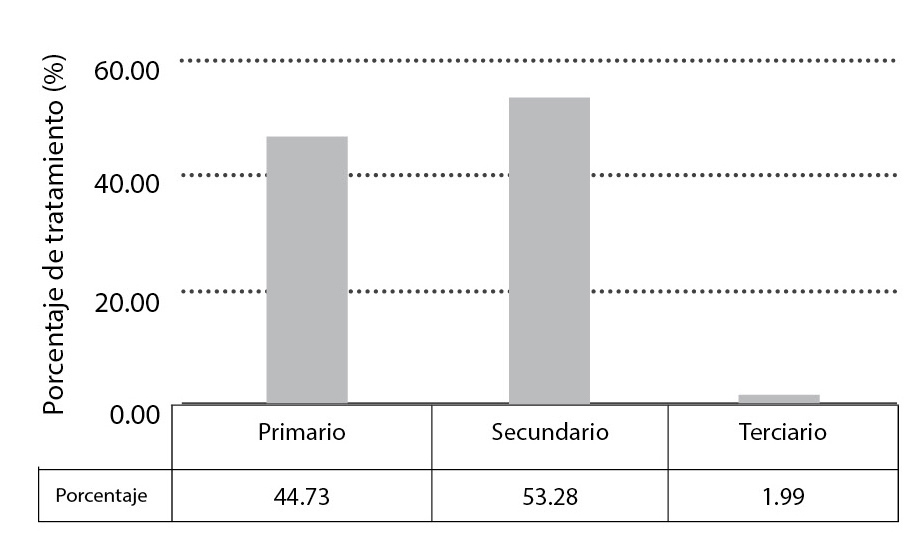
El tratamiento de las aguas industriales se efectúa en 2 639 plantas de la siguiente manera: 826 plantas, con un gasto de operación de 26.55 m3/s, ajustan el pH y remueven materiales orgánicos e inorgánicos en suspensión con tamaño igual o mayor a 0.1 mm, es decir, el tratamiento es de tipo primario. Por otra parte, 1 569 plantas proporcionan tratamiento secundario, con un gasto de operación de 31.63 m3/s. El tratamiento secundario se aplica para remover materiales orgánicos y disueltos. Únicamente 83 plantas se encargan de remover materiales disueltos, que incluyen gases, sustancias orgánicas naturales y sintéticas, iones, bacterias y virus, mediante tratamiento terciario. Estas últimas tienen un gasto de operación de 1.18 m3/s.8 En la figura 3 se proporciona información sobre los porcentajes del caudal de aguas residuales industriales sometidas a diferentes tratamientos.
En Morelos, en 2014 se contaba con 97 plantas para el tratamiento de este tipo de aguas, las cuales tenían una capacidad instalada de 2.13 m3/s y un caudal tratado de 2.09 m3/s, lo que indica que operaban al 98.12% de su capacidad.9 El vertido de aguas residuales, sin tratamiento o con un tratamiento inadecuado, en los cuerpos de agua provoca diferentes niveles de contaminación. En la tabla 1 se muestra la clasificación de la calidad de los cuerpos de agua de acuerdo con varios indicadores.
En 2015 se monitorearon a nivel nacional 2 766 sitios mediante DBO5 y DQO y 3 766 mediante SST. El 6, 26.6 y 5.5% de ellos fueron clasificados como contaminados, según los valores de DBO5, DQO y SST, respectivamente. Estos sitios correspondieron a aguas superficiales con descargas de aguas residuales crudas, principalmente de origen municipal. El 2.5, 5.8 y 1.2% de los sitios se catalogaron como fuertemente contaminados. Estos sitios correspondieron a aguas superficiales con fuerte impacto de descargas de aguas residuales crudas municipales e industriales.
Un tipo de industria que contribuye de manera importante a la contaminación del agua es la industria textil. Ésta produce una enorme cantidad de aguas residuales con una considerable carga contaminante. En México, este sector ocupa el séptimo lugar entre las industrias que originan mayores volúmenes de aguas residuales y está catalogado entre los diez principales contaminantes del ambiente.
Tabla 1
Calidad de cuerpos de agua de acuerdo con varios indicadores
| Calidad del agua | Sólidos suspendidos totales (SST), mg/L | Demanda bioquímica de oxígeno (DBO5), mg/L | Demanda química de oxígeno (DQO), mg/L |
| Excelente | SST ≤ 25 | DBO5 ≤ 3 | DQO ≤ 10 |
| Buena calidad | 25 < SST ≤ 75 | 3 < DBO5 ≤ 6 | 10 < DQO ≤ 20 |
| Aceptable | 75 < SST ≤ 150 | 6 < DBO5 ≤ 30 | 20 < DQO ≤ 40 |
| Contaminada | 150 < SST ≤ 400 | 30 < DBO5 ≤ 120 | 40 < DQO ≤ 200 |
| Fuertemente contaminada | SST > 400 | DBO5 > 120 | DQO > 200 |
La escasez global de agua es un serio desafío para este tipo de industrias, ya que consumen grandes cantidades, las cuales pueden alcanzar entre 25 y 250 m3 de agua por tonelada de producto (dependiendo de los procesos, la calidad final del producto, el tipo y forma de las fibras y la maquinaria y equipo empleados).10 Además, se calcula que origina entre 80 y 200 m3 de agua residual por tonelada de producto.11
En Morelos, el sector textil se ubica principalmente en Cuernavaca, Jiutepec, Cuautla, Emiliano Zapata, Yecapixtla, Temixco, Jojutla, Yautepec y Puente de Ixtla. Al igual que en el ámbito nacional, la falta de infraestructura relacionada con plantas de tratamiento de aguas residuales industriales ocasiona que la mayor parte de estos efluentes se descarguen en ríos y barrancas sin un tratamiento previo.12
Las aguas residuales de la industria textil se caracterizan por una compleja mezcla de contaminantes químicos, una elevada cantidad de sólidos suspendidos y sales disueltas, altos valores de temperatura y pH muy variable.13 La compleja mezcla de contaminantes presentes en las aguas de estas industrias dificulta su tratamiento por procesos biológicos o fisicoquímicos convencionales, por lo que se requiere el empleo de tecnologías innovadoras.
Figura 3
Porcentaje del caudal de aguas residuales industriales sometidas a diferentes tratamientos, 2014
Una fracción considerable de los efluentes de este tipo de aguas está constituida por colorantes, los cuales se producen sobre todo durante el proceso de acabado de telas e hilos. Su presencia, aun en concentraciones de 1 mg/L, es muy visible e indeseable. Cabe resaltar que de las 450 mil toneladas de colorantes orgánicos producidas anualmente, aproximadamente el 50% se consume en la industria textil y más de un 11% se pierde durante su manufactura y utilización en los procesos productivos.14
Los colorantes son compuestos que contienen un grupo de átomos llamados cromóforos, que son responsables de la coloración de la sustancia. Entre los más comunes se encuentran -N=N- (azo), -NO2 (nitro), (C6H5)3CH (trifenilmetano), C=O (carbonilo), entre otros.
Actualmente se producen cerca de cien mil tipos de colorantes y casi el 50% son del tipo azo.15 La mayoría de los azocolorantes utilizados en la industria textil son muy solubles en agua, estables y resistentes a reacciones con agentes químicos. Además, la mayor parte son tóxicos y potencialmente carcinogénicos y mutagénicos, por lo que su remoción de los efluentes industriales es una tarea prioritaria.16
Se han empleado varios métodos para remover los azocolorantes del agua, entre los que destacan los tratamientos fisicoquímicos: coagulación/ precipitación, ósmosis inversa, ultrafiltración, adsorción en carbón activado, entre otros. Sin embargo, la mayoría son costosos, producen lodos, generan subproductos aún más tóxicos que el contaminante original o sólo transfieren el problema de una fase a otra. La biodegradación por hongos y bacterias se ha efectuado con éxito en algunas circunstancias, pero la toxicidad de los azocolorantes y la variabilidad en la composición de este tipo de efluentes dificultan su aplicación.
Para superar estos inconvenientes se ha propuesto el uso de los procesos avanzados de oxidación (pao). Éstos se basan en procesos fisicoquímicos que pueden ocasionar grandes transformaciones en la estructura química de los contaminantes. Los pao involucran la generación de radicales altamente reactivos, entre ellos, los radicales hidroxilo ·OH.17 Estos radicales tienen un gran poder oxidante, no son selectivos y son capaces de descomponer e incluso mineralizar muchos compuestos orgánicos, incluyendo los colorantes. El radical hidroxilo puede producirse por medios fotoquímicos u otras formas de energía.
Figura 4
Procesos que ocurren durante la fotocatálisis heterogénea

Los pao no fotoquímicos incluyen, entre otros, ozonización en medio alcalino (O3/-OH), ozonización con peróxido de hidrógeno (O3/H2O2), plasma no térmico y proceso Fenton (Fe2+/H2O2). Entre los pao fotoquímicos se encuentran los siguientes: UV/H2O2, UV/O3, foto-Fenton y fotocatálisis con TiO2.
A continuación se describen algunas de estas tecnologías:
Ozonización en medio alcalino. El ozono es una sustancia de gran poder oxidante. El O3 se descompone en oxígeno y agua, por lo cual el proceso no es tóxico. El O3 puede reaccionar de forma directa con el contaminante orgánico, pero esta reacción es lenta y selectiva. En medio alcalino, la transformación de los contaminantes ocurre de forma rápida y no selectiva, por medio de radicales (entre ellos ·OH). El ozono puede obtenerse in situ mediante descarga eléctrica en corriente de aire y no deja olores ni sabores. Su empleo implica procesos de transferencia del gas al agua, por lo que existen limitaciones de transferencia de masa. La ozonización necesita de una eficiente agitación, por lo que se requieren difusores y mezcladores en línea, los cuales elevan la inversión. Para la mineralización del contaminante se necesita una relación molar mayor que 5:1 de ozono a contaminante. Como las aguas sometidas al proceso no deben contener ozono residual, se deben desgasificar al final del tratamiento, lo que eleva más el costo de su tratamiento. Esta tecnología se ha utilizado en la decoloración del caolín y de pulpa de celulosa.
Ozonización con peróxido de hidrógeno (O3/H2O2). La combinación de dos o más oxidantes permite aprovechar los efectos sinérgicos entre ellos. Dicho proceso combina la oxidación directa y selectiva del O3 con la oxidación rápida y no selectiva de los radicales ·OH con los contaminantes orgánicos. El peróxido de hidrógeno descompone el ozono mediante transferencia de electrones, consumiéndose ambos y produciendo radicales hidroxilo. El proceso es costoso debido a la inversión asociada al uso de ozono. La combinación de ozono con peróxido de hidrógeno se ha empleado en la degradación de compuestos organoclorados y plaguicidas, así como en la decoloración de aguas residuales de la industria papelera.18
Plasma no térmico. El plasma se produce por una descarga eléctrica de un gas con un haz de electrones de alta energía. Estos plasmas son fuente de especies reactivas de gran poder oxidante, como el O3 y el ·OH, y de reductores, como el H y los propios electrones del plasma. Se ha utilizado para remover contaminantes del aire (óxidos ácidos como NOx y SOx), principalmente, aunque también se ha aplicado para remover contaminantes en agua, como los colorantes. Una ventaja de este método es que no necesita catalizadores, y opera a presiones y temperaturas cercanas al ambiente. Una desventaja es su escalamiento para su implantación real.
Reactivo Fenton. Este proceso ocurre cuando se mezclan soluciones de H2O2 y sales ferrosas. Los iones Fe2+ reaccionan con el peróxido de hidrógeno generando radicales ·OH, los cuales a su vez oxidan los compuestos orgánicos con los que entran en contacto. Se ha demostrado que esta tecnología se puede utilizar para degradar compuestos, como fenoles, bifenilos policlorados, azocolorantes, entre otros. Las ventajas de esta tecnología es que utiliza Fe2+, el cual es abundante, y H2O2, fácil de manejar y ambientalmente benigno. Además, por ser un proceso homogéneo, no tiene limitaciones de transferencia de masa. Las desventajas que presenta son que para llevarse a cabo requiere un pH menor que 3, así como las restricciones ambientales relacionadas con la concentración de Fe2+ en las aguas tratadas. Otros cationes, como el Fe3+ y el Cu2+, pueden provocar procesos semejantes, por lo que a estas reacciones se les conoce como reacciones tipo Fenton.19
Proceso UV/H2O2. La fotólisis del H2O2 por fotones con una longitud de onda de 254 nm, energía mayor a la del enlace oxígeno-oxígeno, genera casi dos ·OH por cada molécula de peróxido de hidrógeno. La descomposición de los contaminantes por la acción de la radiación UV incrementa la eficiencia del tratamiento. Este proceso tiene las siguientes ventajas: el H2O2 se puede adquirir fácilmente y, debido a su solubilidad en agua, no muestra problemas de transferencia de masa. El proceso es fácil de operar y la inversión requerida es mínima. Sin embargo, el proceso es poco eficiente en el tratamiento de aguas con alta absorbancia a longitudes de onda menores que 300 nm. El proceso UV/H2O2 se ha utilizado en la remoción de contaminantes organoclorados, fenoles, plaguicidas y azocolorantes.
Proceso UV/O3. El ozono en agua, cuando es expuesto a radiación UV, genera H2O2. El H2O2, a su vez, se descompone por la acción de la luz UV produciendo radicales ·OH. El H2O2 reacciona con el O3 en exceso formando ·OH adicionales. Este método es una combinación de los procesos UV/H2O2 y O3/ H2O2. Si la radiación es menor que 310 nm, el proceso genera más ·OH debido a la fotólisis del O3, lo cual incrementa la eficiencia. El uso de ozono presenta serias desventajas, las cuales fueron mencionadas anteriormente. Este método se ha utilizado en la degradación de hidrocarburos alifáticos clorados y de bifenilos policlorados, así como en la decoloración de los efluentes de la industria del papel.20
Proceso foto-Fenton. A diferencia del Fenton, este proceso utiliza irradiación luminosa, con longitudes de onda de 300 nm hasta el rango visible, para generar radicales hidroxilo adicionales a los producidos por el reactivo Fenton, lo que incrementa la eficiencia en la degradación de los contaminantes. Una ventaja es que requiere menores concentraciones de Fe2+ y, en caso de utilizar radiación con longitudes de onda menores que 360 nm, se originan radicales ·OH debido a la fotólisis del H2O2. Sin embargo, sigue requiriendo un medio ácido para poder llevarse a cabo de manera importante. Este método se ha utilizado en la degradación de fenoles, herbicidas, plaguicidas, colorantes, entre muchos otros.
Fotocatálisis heterogénea. Se basa en la absorción de energía radiante (ultravioleta o visible) por un semiconductor (fotocatalizador, generalmente TiO2). El proceso inicia cuando se hace incidir radiación de energía suficiente sobre las partículas de catalizador. Éstas son excitadas y originan pares electrón-hueco, los cuales deben migrar a la superficie para que tengan lugar las reacciones de oxidación y reducción con las especies adsorbidas. Además de degradar los contaminantes, los huecos en la superficie pueden reaccionar con las moléculas de H2O, H2O2 o con los iones OH-, y producir radicales ·OH, que forman parte activa en la eliminación del contaminante. Por su parte, los electrones podrían reducir iones metálicos u oxígeno, principal aceptor de electrones en ambientes aeróbicos. Los pares electrón-hueco que no alcanzan a separarse y reaccionar con las especies adsorbidas se recombinan disipando energía. El proceso fotocatalítico descrito anteriormente se presenta en la figura 4. Los semiconductores utilizados como catalizadores son económicos, pues la mayoría puede activarse con radiación de no muy alta energía (λ > 310 nm), lo que posibilita el uso de luz solar.21 La estabilidad del semiconductor y la baja eficiencia de los procesos fotocatalíticos son serias restricciones para este tipo de procesos. La fotocatálisis se ha empleado en la degradación de fenoles, productos farmacéuticos, cianuros, plaguicidas, azocolorantes y eliminación de iones metálicos, entre otros.22
El tratamiento de los efluentes industriales mediante los procesos avanzados de oxidación permitirá disponer de ellos para su descarga en los cuerpos de agua sin ocasionar efectos nocivos en el ambiente o para reutilizarlos en procesos productivos.
• Escuela de Estudios Superiores de Xalostoc (eesux), Universidad Autónoma del Estado de Morelos (uaem)
Notas
1 Sistema Nacional de Información del Agua (sina), conagua, http://bit.ly/2zuYz6V, consultado en septiembre de 2016.
2 Glosario de educación ambiental, semarnat, http://bit.ly/2isOJYa, consultado en septiembre de 2016.
3 Sistema Nacional..., loc. cit.
4 NOM-001-ECOL-1996, Que establece los límites máximos permisibles de contaminantes en las descargas de aguas residuales en aguas y bienes nacionales, dof, 6 de enero de 1997, http://bit.ly/2ojEAzm
5 Estadísticas del agua en México. Edición 2013, semarnat, México df, 2013, pp. 104-111, http://bit.ly/2iXt26v
6 Sistema Nacional..., loc. cit.
7 Idem.
8 Estadísticas del agua..., op. cit.
9 Sistema Nacional..., loc. cit.
10 Juan Matías Chacón, María Teresa Leal, Manuel Sánchez y Erick R. Bandala, “Solar photocatalytic degradation of azo-dyes by photo-Fenton process”, Dyes and Pigments, vol. 69, núm. 3, 2006, pp. 144-150, http://bit.ly/2xXeTc7
11 Juan Quintero, Mariana Cardona y Juliana Osorio, “Degradación de colorantes industriales con hongos ligninolíticos”, Revista Facultad de Ingeniería, núm. 48, 2009, pp. 27-37, http://bit.ly/2lMSA7C; M. Solís, J.L. Gil, A. Solís, H.I. Pérez, N. Manjarrez y M. Perdomo, “El proceso de sedimentación como una aplicación sencilla para reducir contaminantes en efluentes textiles”, Revista Mexicana de Ingeniería, vol. 12, núm. 3, 2013, pp. 585-594, http://bit.ly/2ziIWhR
12 Estadísticas del agua..., op. cit.
13 M. Solís et al., “El proceso...”, op. cit.
14 E.A. El-Sharkawy, A. Y. Solimanb y K.M. Al-Amer, “Comparative study for the removal of methylene blue via adsorption and photocatalytic degradation”, Journal of Colloid and Interface Science, vol. 310, núm. 2, 2007, pp. 498-508, http://bit.ly/2iY1wpD
15 J.M. Chacón et al., “Solar photocatalytic…”, op. cit.
16 H.A. Alhassani, M.A. Rauf y S.S. Ashraf, “Efficient microbial degradation of Toloudine Blue dye by Brevibacillus sp”, Dyes and Pigments, vol. 75, 2007, pp. 395-400, http://bit.ly/2zepUKa
17 T. Shahwan, S. Abu Sirriah, M. Nairat, E. Boyaci, A.E. Eroglu, T.B. Scott y K.R. Hallam, “Green synthesis of iron nanoparticles and their application as a Fenton-like catalyst for the degradation of aqueous cationic and anionic dyes”, Chemical Engineering Journal, vol. 172, 2011, pp. 258-266, http://bit.ly/2hEoSgk; H.A. Alhassani et al., “Efficent microbial…”, op. cit.
18 Xavier Domenech, Wilson F. Jardim y Marta I. Litter, “Eliminación de contaminantes por fotocatálisis heterogénea”, Miguel A. Blesa (ed.), Procesos avanzados de oxidación para la eliminación de contaminantes, Red cydted viii-g, Buenos Aires, 2001, pp. 3-26, http://bit.ly/2AhQ3Fq
19 M. Neamtu, A. Yediler, I. Siminiceanu, M. Macoveanu y A. Kettrup, “Decolorization of disperse red 354 azo dye in water by several oxidation processes-a comparative study”, Dyes and Pigments, vol. 60, 2004, pp. 61-68, http://bit.ly/2Ajwrkz
20 Xavier Domenech et al., “Eliminación…”, op. cit.
21 “Eliminación de contaminantes emergentes mediante fotocatálisis solar”, 11 de febrero de 2016, imta, http://bit.ly/2ysZapC, consultado en septiembre de 2016.
22 M.A. Rauf y S.S. Ashraf, “Fundamental principles and application of heterogeneous photocatalytic degradation of dyes in solution”, Chemical Engineering Journal, vol. 151, 2009, pp. 10-18, http://bit.ly/2hEbc4W; Y.-H. Hsien, C.-F. Chang, Y.-H. Chen y S. Cheng, “Photodegradation of aromatic pollutants in water over TiO2 supported on molecular sieves”, Applied Catalysis B: Environmental, vol. 31, 2001, pp. 241-249, http://bit.ly/2A5CaJv