Análisis no lineal de la dinámica del cáncer
Raúl Peralta•
Homero Garcés ••
Germinal Cocho •••
Pedro Miramontes ••
l cáncer es una de las enfermedades complejas de mayor prevalencia a nivel mundial. El aumento de casos de este padecimiento se debe a una mayor exposición a los factores de riesgo relacionados en gran parte con el estilo de vida. Estos factores tienen la capacidad de interactuar con los genes moduladores del crecimiento y la diferenciación celular, y de producir mutaciones o alteraciones en el genoma. Tales mutaciones inducen un cambio en la dinámica de interacciones génicas en el interior de la célula, modificando la estabilidad de las redes de regulación génica característica de cada fenotipo celular.
Las redes de regulación génica se estudian formalmente en la teoría matemática de la dinámica no lineal y sus propiedades las hacen parte esencial de la teoría de los sistemas complejos. Bajo la dinámica de cambio que imponen las contradicciones de la conmutación entre los estados de actividad e inactividad de los genes, se pueden alcanzar estados en los que la red completa llega a uno estacionario, a los cuales se les denomina atractores. El concepto de atractor del cáncer, como marco conceptual de la teoría de sistemas dinámicos, explica la capacidad de una red de regulación génica en un genoma de producir una diversidad de fenotipos celulares estables, incluyendo el fenotipo canceroso, o de conducir el proceso de diferenciación celular. Asimismo, explica al cambio de fenotipos como una transición entre atractores que, de la misma manera, nos permiten dilucidar el carácter reversible de enfermedades como el cáncer.1
La visión genético-molecular considera el cáncer como una enfermedad genética, es decir, una enfermedad causada por factores ambientales que dañan o mutan genes esenciales en la regulación del ciclo celular, en los procesos de reparación del dna y en la muerte celular programada o apoptosis. Tales daños confieren ventajas adaptativas a las células para proliferar de manera no regulada y eventualmente conducir a una propagación de aquéllas transformadas a otras partes del cuerpo, lo que finalmente conduce a la muerte del organismo.2
A pesar de que existen alrededor de doscientos tipos de tumores originados de una gran variedad de células, el fenotipo que éstas exhiben es una manifestación de alguna de las diez alteraciones esenciales en la fisiología celular que colectivamente conducen al crecimiento maligno: mantenimiento de señales proliferativas; insensibilidad a las señales de inhibición de crecimiento; evasión de la apoptosis; adquisición de inmortalidad replicativa; angiogénesis sostenida; activación de invasión y metástasis; inestabilidad genómica; inflamación tumoral; reprogramación del metabolismo, y evasión de la respuesta inmune.3 Cada uno de estos cambios en el fenotipo celular representa la adquisición de una nueva dinámica de interacciones génicas dentro de la célula que tiene como consecuencia cambios en los perfiles de expresión génica, lo que se hace evidente en la transformación celular. A causa de este proceso se genera una trayectoria o destino en el perfil de expresión que converge hacia un nuevo estado celular estable. A este estado estacionario se le denomina atractor del cáncer.4
En el campo matemático de los sistemas dinámicos existe un marco conceptual que define el término de “atractor” como un estado estable dentro de las redes de regulación génica y que corresponde a distintos fenotipos celulares. Estas interacciones génicas son dinámicas y forman redes que pueden existir en un número finito de estados. En consecuencia, las mutaciones que pueden afectar estas redes son capaces de afectar el fenotipo celular. En este sentido, las perturbaciones capaces de alterar la red génica tienen el potencial de inducir un cambio en el fenotipo celular, entendido como un cambio entre atractores, que a su vez puede explicar el carácter reversible del cáncer.5
El cáncer como una enfermedad genética
La visión del cáncer como una enfermedad genética se ha sostenido durante muchos años por los hallazgos de mutaciones en genes que se asocian con la transformación celular. Consecuentemente, se han realizado considerables esfuerzos para la identificación de genes específicos marcadores del cáncer. Tal es el caso de los genes brca1 y brca2 que se describieron en los años noventa como participantes del cáncer de mama y ovario hereditarios y que en la actualidad se han incorporado a la práctica clínica cotidiana en el campo del diagnóstico molecular. Los tipos de mutaciones que se han reportado para estos genes consisten en la generación de una proteína truncada no funcional, que produce una incapacidad celular para reparar daños en el dna. La detección de mutaciones en estos genes conduce a una estrategia de inducción terapéutica diferente a la asociada con la administración de cisplatino, el cual genera rupturas de doble cadena en el dna como mecanismo de acción. El pronóstico se consideraba como reservado o de mala respuesta al tratamiento.6
El caso del gen erbb2 (Her2-neu) es similar. Éste se reportó en los años ochenta como un gendel cáncer de mama. Desde entonces se han realizado múltiples estudios que apoyan la evidencia biológica de su sobreexpresión como factor de mal pronóstico en pacientes con cáncer de mama, de cabeza y cuello, pulmón, colon y recto. La función principal de este gen es la de receptor del factor de crecimiento epidermal, que al ser sobreestimulado por un mecanismo de amplificación génica conduce a un crecimiento descontrolado de las células epiteliales blanco. Sin embargo, al ser dilucidado su mecanismo de acción molecular se pudo desarrollar una estrategia terapéutica basada en una inmunoterapia que en la actualidad mejora significativamente el pronóstico en los pacientes estudiados.7
Con esta visión genético-molecular se ha logrado el hallazgo de al menos quinientos genes causales del cáncer y asociados a determinados fenotipos y, al mismo tiempo, otra vertiente de la investigación ha dilucidado las características esenciales que conducen a la transformación maligna, en particular la activación del proceso de invasión y metástasis, el cual inicia en un proceso de transición epitelio-mesénquima que pone a la vista la influencia de factores epigenéticos en el desarrollo del fenotipo maligno (figura 1). Durante este proceso, la célula cancerosa es influenciada fuertemente por señales de regulación extracelular y del tejido adyacente, particularmente de la matrix extracelular, mediante la transmisión de señales intracelulares a través de un proceso de mecanotransducción.
Figura 1
Transición epitelio-mesénquima
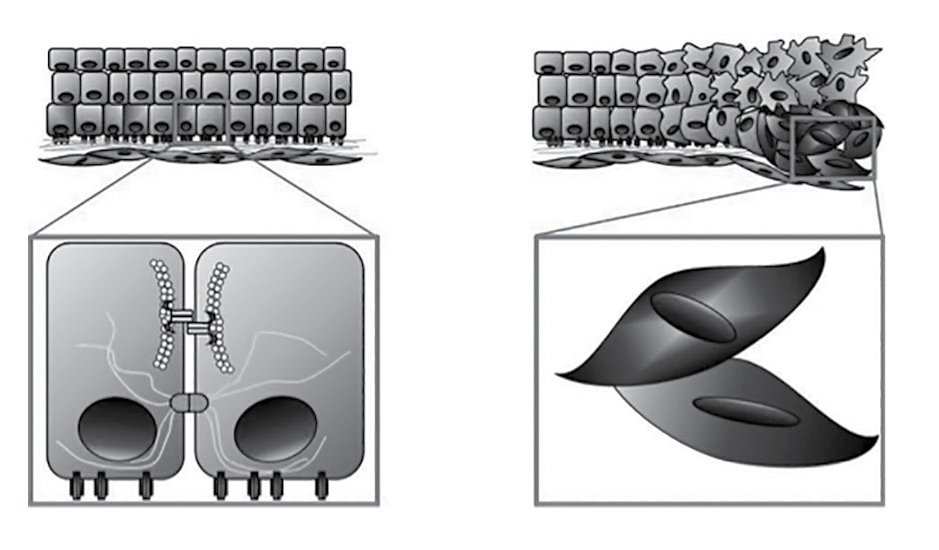
La formación del tumor primario es seguida por un proceso regulado de transición de células epiteliales hacia células mesenquimales. Al inicio de la transición se manifiesta la pérdida de moléculas de adhesión entre las células epiteliales, seguida por un cambio en la configuración espacial de la célula o del fenotipo. Las células adquieren un fenotipo mesenquimal y la capacidad de invadir el estroma, pasar al torrente sanguíneo e invadir un tejido secundario.
Los cambios en la estructura de la matrix extracelular inducen alteraciones en la estructura del citoesqueleto mediante la transmisión de señales mediada por mecanorreceptores específicos, como las integrinas, que actúan como iniciadores del cambio conformacional de la célula.8 En la actualidad, con los datos disponibles de genomas se han desarrollado nuevas herramientas para el análisis de las interacciones génicas y redes genéticas, lo cual abre el campo de un nuevo marco conceptual basado en conceptos matemáticos.
Sistemas dinámicos y atractores como marco conceptual en la carcinogénesis
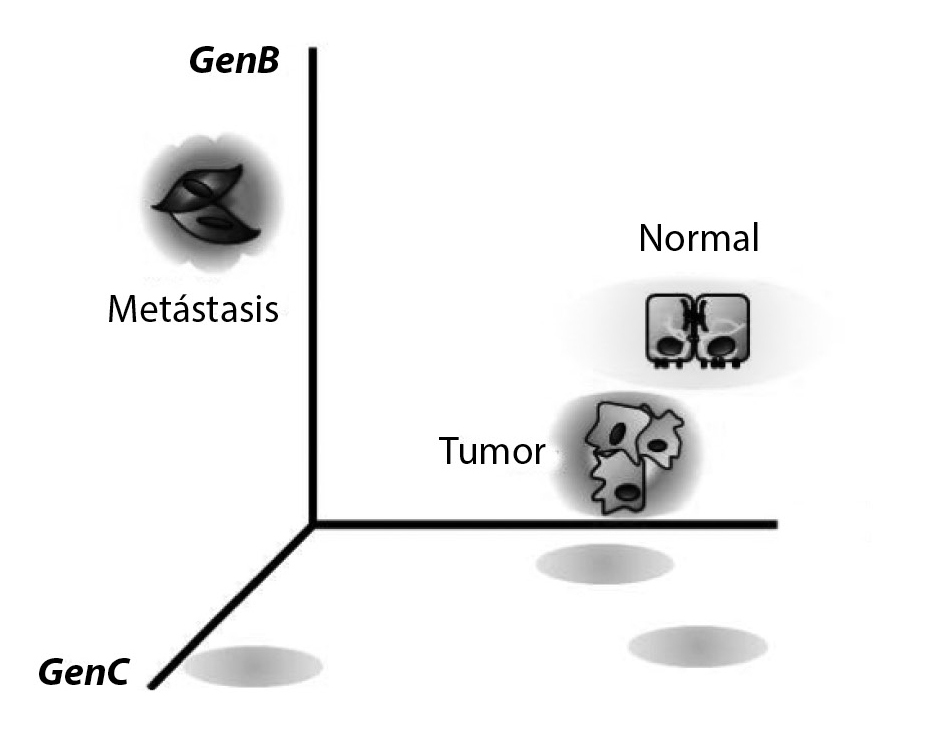
En el campo de la dinámica de sistemas existe un marco conceptual que define los términos de espacio del estado y atractores, que representan estados estables dentro de las redes de regulación génica y que corresponden a distintos fenotipos celulares. En este sentido, la manera de representar la expresión de genes en un momento dado dentro de una célula es mediante un eje coordenado de n dimensiones, donde “n” depende del número de genes considerados en el sistema, siendo un eje coordenado de dos dimensiones cuando se consideran sólo dos genes. Si consideramos la expresión de todos los genes (alrededor de veinticinco mil) tendríamos un sistema coordenado de esa dimensión.
El estado final de una célula o célula diferenciada representa un estado final de expresión e interacción entre sus genes. A éste se le denomina atractor. En este sentido, pueden existir tantos estados finales o atractores teóricos que dependen del número de genes considerados en el sistema, lo que abre la posibilidad de transitar de un atractor hacia otro.9 La célula transformada representa un atractor que comenzó con una mutación inicial y cambió la dinámica de interacciones génicas. Esta noción tiene implicaciones clínicas en el tratamiento del cáncer mediante el bloqueo de la perturbación génica que inicialmente causó el cambio en la dinámica celular, de tal manera que permite transitar hacia el atractor previo a la transformación celular.1010
El proceso de transformación celular mantiene una analogía con el proceso de diferenciación. Las células adquieren una serie de características, como el fenotipo mesénquima (célula indiferenciada) en el inicio de la invasión y metástasis, que se manifiesta en el cambio de interacciones entre los genes. Nuevamente, esta noción abre la posibilidad de pasar de un atractor canceroso hacia uno benigno.11
En la actualidad, la formalización matemática permite explicar distintos modelos de regulación génica, por ejemplo, en la estirpe hematopoyética, la célula progenitora mieloide inicia un proceso de diferenciación, el cual tiene como destino la célula mieloide o eritroide. Este destino lo determinan los niveles de expresión de dos factores de transcripción, pu.1 y gata1, los cuales promueven el destino entre la célula mieloide o eritroide, respectivamente. Los niveles de expresión tanto de pu.1 como de gata1 influyen en el destino hacia un linaje u otro.
Recientemente se describió un nuevo mecanismo de diferenciación que nos indica que el estado diferenciado puede emerger de la velocidad de unión y desunión de las proteínas de regulación, como son los factores de transcripción en sus sitios blancos localizados en las secuencias promotoras. Este proceso de unión y desunión al promotor se presenta en los múltiples estados diferenciados.12
En principio, este sistema de regulación binaria, que puede conducir a la célula hacia un linaje u otro, se observa en otros contextos celulares, incluyendo el cáncer. De esta manera, la sobreexpresión génica de un grupo de genes en una célula cancerosa y el silenciamiento génico en otro grupo de genes pueden ser vistos como un circuito de regulación génica con “bucles” de retroalimentación positiva y negativa que le confieren una nueva dinámica a la red de interacciones génicas dentro de la célula cancerosa.13
Las mutaciones en la transición hacia los atractores del cáncer
La noción de atractor del cáncer se sustenta en el destino final de interacción entre los genes considerados para el proceso de transformación celular. Estas interacciones son representadas en redes (sus propiedades son estudiadas en la teoría de grafos en matemáticas). El inicio de la transformación celular comienza con un evento de mutación o mutaciones en el genoma, que inciden en un cambio de interacciones génicas las cuales conducen a un destino o atractor del cáncer. En la actualidad, la expresión de genes en cada estado celular o atractor se puede estudiar experimentalmente mediante tecnologías genómicas (microarreglos de expresión, rna seq), las cuales proporcionan el perfil de expresión de genes de un genoma completo en determinadas condiciones. A partir de estos datos también es posible inferir las interacciones entre los genes.
PPor ejemplo, podemos inferir aquellos genes que se encuentran “apagados” o “encendidos” sólo con ver su expresión. Asimismo, podemos enfocarnos en determinados genes y realizar otros experimentos de knockdown (modificación) o knockout (bloqueo o inactivación) para estudiar sus efectos en determinados genes. De esta manera, podemos ir construyendo la red de interacciones entre los genes en una condición normal o sana y en una condición patológica. El cambio en las interacciones génicas conduce a un cambio de fenotipo. Éste explica cómo una red de regulación génica en un simple genoma tiene la capacidad de producir una diversidad de fenotipos celulares estables.14
Los proyectos de secuenciación del genoma del cáncer proveen un estimado de las mutaciones en el genoma tumoral. Se ha calculado que este genoma contiene un aproximado de diez a doscientas mutaciones que no se encuentran en su contraparte sana, con una gran variabilidad entre los distintos tipos de tumores, de tal manera que en la mayoría de los tumores se encuentran unas cuantas mutaciones, mientras que la mayoría de las mutaciones se observan en menos del 5% de los tumores. La disponibilidad de transcriptomas tumorales permite realizar el análisis de agrupamiento, con base en sus perfiles de expresión, lo cual muestra una correlación con la clasificación tradicional derivada de los marcadores morfológicos y bioquímicos. Por ejemplo, en el cáncer de pulmón se pueden encontrar cuatro grupos distinguibles que comprenden más del 95% de todas las neoplasias pulmonares y los cuales mantienen perfiles de expresión similares.15
Desde la postulación del paisaje epigenético de Waddington y la aportación de Kauffman a la teoría de redes, podemos desarrollar un marco conceptual que explique el proceso de carcinogénesis como una transición de atractores.16 La perspectiva del paisaje atractor enfatiza la contribución epigenética de la formación del tumor y la metástasis. En los tumores sólidos, la propagación de células de su sitio primario a sitios distantes se considera como la principal causa de muerte asociada a estos cánceres.
Este proceso de migración es favorecido por la conversión del estado epitelial al estado mesenquimal, el cual una vez establecido puede invadir el tejido adyacente en la matrix extracelular. Los carcinomas provenientes de epitelio no son móviles, mientras que las células mesenquimales migran fácilmente. Es por ello que la transición epitelio-mesénquima (emt) se considera como un evento central en el proceso de propagación tumoral o metástasis.17 La función de los factores epigenéticos en la formación del cáncer se extiende no únicamente a las modificaciones covalentes en el cromosoma, sino que incluye cambios en el microambiente del estroma, como los de la matrix extracelular (me) y los mecánicos.
EEl microambiente del tumor parte del hecho de que la interacción entre las células cancerosas y las células del estroma determina el crecimiento del tumor, de tal manera que, por una parte, la construcción de un nicho precanceroso es un paso necesario para la sobrevivencia de las células iniciadas y, por otra, su expansión va acompañada de la promoción y progresión del tumor.18 Las células estabilizan mecánicamente la forma de su citoesqueleto utilizando una arquitectura de tensegridad, y pueden cambiar de forma con un consumo de energía mínimo, dado lo cual pueden cambiar entre epitelio y mesénquima durante la transición epitelio-mesénquima y mesénquimaepitelio, respectivamente.
En ambos casos, la tensegridad representa una configuración estable de fuerza balanceada dentro de un atractor que, al cambiar esta configuración, nos conduce a una transición de atractor. La propiedad de arquitectura de tensegridad del citoesqueleto celular confiere a la célula una resistencia natural a las mutaciones al azar que presenta el genoma de un epitelio estable. De tal manera, las mutaciones génicas en algunos casos no son determinantes en la transformación celular, sino que requieren de cambios en la estructura de la matrix extracelular para el desarrollo del cáncer.1919
El pronóstico del cáncer como una transición entre atractores
La visión clásica heredada por los anatomoclínicos sugiere que, dada la morfología indiferenciada que caracteriza a la célula del cáncer, ésta representa una forma aberrante del desarrollo celular. El grado de inmadurez del fenotipo de la célula del cáncer se asocia con el grado de malignidad, y son los tumores con características indiferenciadas los de mayor agresividad y de mal pronóstico. Asimismo, mediante la observación clínica se ha determinado que un tumor, visto como una población de células cancerosas, es heterogéneo y continuamente está produciendo una variedad de fenotipos celulares, cuyo grado de heterogeneidad constituye otro marcador clínico del pronóstico del cáncer.20 Ahora, con el marco conceptual de redes y atractores, podemos explicar el cáncer como una aberración en sus interacciones génicas.
La transición entre atractores abre la posibilidad de revertir el cáncer, donde aquellos casos de mal pronóstico o mal desenlace clínico son los atractores del cáncer con una cuenca de atracción mayor que le confiere a la célula un estado de irreversibilidad, mientras que aquellos de buen pronóstico o buen desenlace clínico son los atractores con una cuenca de atracción menor que le confiere a la célula un carácter de reversibilidad. El efecto irreversible y las transiciones entre atractores explica por qué una célula puede permanecer en el atractor del cáncer incluso después de que el estímulo inductor de la transición ha desaparecido.
Figura 2
Modelo terapéutico basado en blanco específico
En una célula normal, la red de interacción génica mantiene una configuración estable. Al transformarse la célula, esta red cambia su configuración como consecuencia de la mutación en nodos centrales, lo que conduce a un cambio mayor en la progresión a metástasis. Al utilizar como blancos terapéuticos los nodos centrales se tiene la posibilidad de afectar la red de interacciones, las cuales pueden inducir la respuesta favorable.
En el caso del cáncer, esto implica una pérdida de dependencia de la molécula inductora de la transición o cancerígena, lo que impide la buena respuesta a las terapias con drogas específicas (figura 2).21 Los atractores permiten explicar el carácter reversible de enfermedades como el cáncer. Partiendo de que un mismo tipo de cáncer le confiere a los pacientes desenlaces terapéuticos distintos, éste se puede modelar en el contexto de sistemas dinámicos como un proceso de bifurcación que genera diferentes destinos, característicos de cada atractor.
• Profesor-investigador, Centro de Investigación en Dinámica Celular (cidc), Universidad Autónoma del Estado de Morelos (uaem)
•• Facultad de Ciencias, Universidad Nacional Autónoma de México (unam)
••• Instituto de Física, unam
Notas
1 Pedro Miramontes, Raúl Peralta, Homero Garcés y Germinal Cocho, “Carcinogénesis y complejidad”, Interdisciplina, vol. 3, núm. 6, 2015, pp. 63-82, http://bit.ly/2G2Knlq
2 Gerard I. Evan y Karen H. Vousden, “Proliferation, cell cycle and apoptosis in cancer”, Nature, vol. 411, núm. 6835, 2001, pp. 342-348, doi: 10.1038/35077213
3 Douglas Hanahan y Robert A. Weinberg, “Hallmarks of cancer: the next generation”, Cell, vol. 144, núm. 5, 2011, pp. 646-674, doi: 10.1016/j.cell.2011.02.013
4 Pedro Miramontes et al., “Carcinogénesis…”, op. cit., p. 63.
5 Pau Creixell, Erwin M. Schoof, Janine T. Erler y Rune Linding, “Navigating cancer network attractors for tumor-specific therapy”, Nature Biotechnology, vol. 30, núm. 9, 2012, pp. 842-848, doi: 10.1038/nbt.2345
6 Moufida Bensam, Elsayed Hafez, Doaa Awad, Muhammad El-Saadani y Mahmoud Balbaa, “Detection of new point mutations of brca1 and brca2 in breast cancer patients”, Biochemical Genetics, vol. 52, núm. 1-2, 2013, pp. 15-28, doi: 10.1007/s10528-013-9623-8
7 Nathalie S. Dhomen, John Mariadason, Niall Tebbutt y Andrew M. Scott, “Therapeutic targeting of the epidermal growth factor receptor in human cancer”, Critical Reviews in Oncogenesis, vol. 17, núm. 1, 2012, pp. 31-50, doi: 10.1615/CritRevOncog.v17.i1.40
8 Pengfei Lu, Valerie M. Weaver y Zena Werb, “The extracellular matrix: a dynamic niche in cancer progression”, Journal of Cellular Biology, vol. 196, núm. 4, 2012, pp. 395-406, doi: 10.1083/jcb.201102147
9 Sui Huang y Donald E. Ingber, “A non-genetic basis for cancer progression and metastasis: self-organizing attractors in cell regulatory networks”, Breast Disease, vol. 26, 2006-2007, pp. 27-54, doi: 10.3233/BD-2007-26104
10 Ibid., p. 27.
11 Idem.
12 Haidong Feng y Jin Wang, “A new mechanism of stem cell differentiation through slow binding/unbinding of regulators to genes”, Scientific Reports, vol. 2, 2012, p. 550, doi: 10.1038/srep00550
13 Ibid., p. 550.
14 Sui Huang, Ingemar Ernberg y Stuart Kauffman, “Cancer attractors: a systems view of tumors from a gene network dynamics and developmental perspective”, Seminaries of Cellular Development Biology, vol. 20, núm. 7, 2009, pp. 869-876, doi: 10.1016/j.semcdb.2009.07.003
15 Yuchun Guo, Gabriel S. Eichler, Ying Feng, Donald E. Ingber y Sui Huang, “Towards a holistic, yet gene-centered analysis of gene expression profiles: a case study of human lung cancers”, Journal of Biomedicine and Biotechnology, vol. 2006, núm. 2006, p. 69141, doi: 10.1155/JBB/2006/69141
16 Sui Huang et al., “Cancer attractors…”, op. cit., p. 869.
17 Bryce J. W. van Denderen y Erik W. Thompson, “Cáncer: The to and fro of tumour spread”, Nature, vol. 493, 2013, pp. 487-488, doi: 10.1038/493487a
18 Mary Helen Barcellos-Hoff, David Lyden y Timothy C. Wang, “The evolution of the cancer niche during multistage carcinogenesis”, Nature Reviews Cancer, vol. 13, 2013, pp. 511-518, doi: 10.1038/nrc3536
19 Sui Huang et al., “A non-genetic basis…”, op. cit., p. 27.
20 Michael W. Schmitt, Marc J. Prindle y Lawrence A. Loeb, “Implications of genetic heterogeneity in cancer”, Annals of the New York Academy of Sciences, vol. 1267, 2012, pp. 110-116, doi: 10.1111/j.1749-6632.2012.06590.x
21 Pedro Miramontes et al., “Carcinogénesis…”, op. cit., p. 63.